【答案】
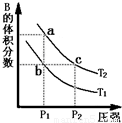
分析:(1)A(g)?2B(g)△H>0,该反应为吸热反应,升高温度,化学平衡正向移动,B的体积分数增大,故T
1<T
2;增大压强,化学平衡逆向移动,B的体积分数减小,结合图象来分析解答.
A.a、c两点都在等温线上,压强越大,反应速率越快;
B.压强相同,升高温度,化学平衡正向移动,B的体积分数增大,a点B的体积分数大;
C.根据b、c两点平衡体系中NO
2的体积分数相等来判断;
(2)当化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再发生变化,由此衍生的一些物理性不变,以此解答该题;
(3)减小体积增大压强,平衡向逆反应方向移动,移动的结果是降低B的浓度增大,但不会消除增大;
(4)①根据公式反应速率v=
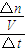
计算v(B),再根据速率之比等于化学计量数之比计算v(A);
②化学平衡状态时,各组分的浓度不再随时间的改变而改变;
计算平衡时各组分的平衡浓度,代入平衡常数表达式k=
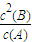
计算;
反应2B(g)?A(g)为放热反应,温度升高,平衡体系向着吸热的方向进行,据此判断K的变化情况;
③该容器只充入的是A气体,恒温恒容下,要达到上述同样的平衡状态,为等效平衡,按化学计量数转化应得到0.4mol的B,据此计算A的起始浓度.
解答:解:(1)A.由图象可知,a、c两点都在等温线上,c的压强大,压强越大,反应速率越快,则a、c两点的反应速率:a<c,故a错误;
B.升高温度,化学平衡正向移动,B的体积分数增大,由图象可知,a点B的体积分数大,则T
1<T
2,由状态b到状态a,可以用加热的方法,故B正确;
C.b、c两点平衡体系中B的体积分数相等,气体的平均相对分子质量:b=c,故C正确;
故答案为:BC;
(2)A.单位时间内生成n mol A的同时分解2n molB,都表示逆反应速率,反应始终按此比例进行,不能说明到达平衡状态,故A错误;
B.到达平衡时各组分的含量不变,两种气体的体积分数不再改变,说明到达平衡,故B正确;
C.v
正(A)=2v
逆(B),即v
正(A):v
逆(B)=2:1,不等于化学计量数之比,反应到达平衡状态,向正反应进行,故C错误;
D.混合气体的总质量不变,容器的容积不变,混合气体的密度始终不变,故D错误;
E.随反应进行,反应混合物的总物质的量增大,压强增大,混合气体的压强不再发生变化,说明到达平衡状态,故E正确;
故答案为:BE;
(3)减小体积增大压强,平衡向逆反应方向移动,移动的结果是降低B的浓度增大,但不会消除增大,到达新平衡时B浓度大于0.1mol/L,故答案为:>;
(4)①从反应开始直至40s时,v(B)=
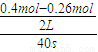
=0.00175mol/(L?s),速率之比等于化学计量数之比,故v(A)=

v(B)=

×0.00175mol/(L?s)=0.000875mol/(L?s),
故答案为:0.000875mol/(L?s);
②在60s、80s时,A的物质的量都是0.08mol,反应处于平衡状态,所以n
3=n
4,A的平衡浓度为
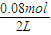
=0.04mol/L,B的平衡浓度为
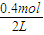
-2×0.04mol/L=0.12mol/L,反应的平衡常数k=
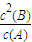
=
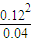
=0.36,
反应2B(g)?A(g)为放热反应,温度升高,平衡体系向逆反应方向移动,平衡常数k减小,
故答案为:=;0.36;减小;
③该容器只充入的是A气体,恒温恒容下,要达到上述同样的平衡状态,为等效平衡,按化学计量数转化应得到0.4mol的B,故起始充入的A气体物质的量为0.4mol×

=0.2mol,A的起始浓度是
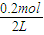
=0.1mol?L
-1,
故答案为:0.1.
点评:本题考查化学平衡图象、化学平衡影响因素与计算、反应速率计算、化学平衡常数、等效平衡等,题目较为综合,难度中等,(4)③中注意等效平衡的利用.

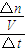 计算v(B),再根据速率之比等于化学计量数之比计算v(A);
计算v(B),再根据速率之比等于化学计量数之比计算v(A);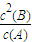 计算;
计算;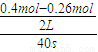 =0.00175mol/(L?s),速率之比等于化学计量数之比,故v(A)=
=0.00175mol/(L?s),速率之比等于化学计量数之比,故v(A)= v(B)=
v(B)= ×0.00175mol/(L?s)=0.000875mol/(L?s),
×0.00175mol/(L?s)=0.000875mol/(L?s),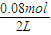 =0.04mol/L,B的平衡浓度为
=0.04mol/L,B的平衡浓度为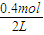 -2×0.04mol/L=0.12mol/L,反应的平衡常数k=
-2×0.04mol/L=0.12mol/L,反应的平衡常数k=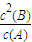 =
=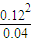 =0.36,
=0.36, =0.2mol,A的起始浓度是
=0.2mol,A的起始浓度是 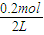 =0.1mol?L-1,
=0.1mol?L-1,

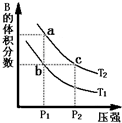 对于反应A(g)?2B(g)△H>0,在温度为T1、T2时,平衡体系中B的体积分数随压强变化的曲线如图所示.回答下列各题.
对于反应A(g)?2B(g)△H>0,在温度为T1、T2时,平衡体系中B的体积分数随压强变化的曲线如图所示.回答下列各题.