
| c(H+) |
| c(HF) |


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
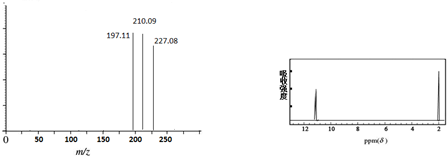
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
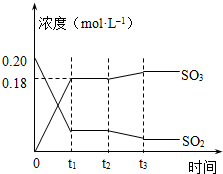 已知2SO2 (g)+O2(g)?2SO3(g)△H=-196kJ?mol-1,5000C时将2mol SO2和1molO2装入一体积恒定的10L密闭容器中,2分钟(t1)时达到平衡.如图所示:
已知2SO2 (g)+O2(g)?2SO3(g)△H=-196kJ?mol-1,5000C时将2mol SO2和1molO2装入一体积恒定的10L密闭容器中,2分钟(t1)时达到平衡.如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | Q | R | X | Z | ||
| 微粒信息 | 离子: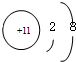 |
单质分子: R2 |
离子: X3+ |
一种原子:
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com