
| 元素代号 | Q | R | X | Z | ||
| 微粒信息 | 离子: |
单质分子: R2 |
离子: X3+ |
一种原子:
|


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:
| A、Cl2与H2O反应:Cl2+H2O═2H++ClO-+Cl- |
| B、向Na2SiO3溶液中通入过量的CO2:SiO32-+CO2+H2O═H2SiO3↓+CO32- |
| C、向AlCl3溶液中滴加氨水至过量:Al3++3OH-═Al(OH)3↓ |
| D、将铜片投入浓硝酸中:Cu+2NO3-+4H+=Cu2++2NO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(H+) |
| c(HF) |
查看答案和解析>>
科目:高中化学 来源: 题型:

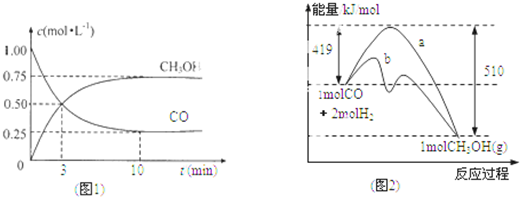
| n(CH3OH) |
| n(CO) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| n(CH3OH) |
| n(CO) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | 时间 浓度 温度/℃ |
0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 820 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | c1 | 0.20 |
| 3 | 800 | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 4 | 800 | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:
- 4 |
| A、发生还原反应的是H2C2O4 |
| B、该离子方程式右侧方框内的产物是OH- |
| C、10mol CO2生成时,电子转移5mol |
| D、1mol乙二酸分子中含有7mol σ键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com