
【题目】某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。

(1)实验室用装置A制备SO2,某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未流下,可能的原因是_____________(合理均可);C装置的作用___________________。
(2)反应开始一段时间后,观察到B、D两个试管中的品红溶液都褪色,停止通气后,再给B、D两个试管分别加热;两个试管中的现象分别为:B:_______________,D:________________。
(3)若将B中品红换成H2S溶液,通SO2一段时间后B中现象为_____,该反应的化学方程式为______,其中氧化产物与还原产物的物质的量之比为________。
(4)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强。他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示)___________________。
【答案】未取下分液漏斗的玻璃塞 吸收SO2和Cl2,防止污染空气 褪色的品红溶液又恢复成红色 无明显现象 溶液变浑浊(或有淡黄色沉淀生成) 2H2S+SO2==3S↓+2H2O 2:1 Cl2+SO2+2H2O=2HCl+H2SO4
【解析】
实验目的是探究和比较SO2、氯水的漂白性,根据装置图,装置A制备SO2,装置E应为制备Cl2,SO2具有漂白性,能使品红溶液褪色,SO2、Cl2有毒,必须尾气处理,即装置C的作用是吸收尾气SO2和Cl2,然后逐步分析;
(1)使用分液漏斗时,将分液漏斗颈上的玻璃塞打开,或者使塞上的凹槽(或小孔)对准漏斗上的小孔,便于液体滴下,因此题中漏斗中的液体未流下,说明未取下分液漏斗的玻璃塞或塞上的凹槽(或小孔)与准漏斗上的小孔未对准;SO2和Cl2对环境有危害,必须进行尾气处理,因此装置C的作用是吸收SO2和Cl2,防止污染空气;
(2)SO2能使品红溶液褪色,原理是SO2与品红结合生成不稳定的物质,受热或见光有恢复原来的颜色,即装置B中加热,出现的现象是褪色的品红溶液又恢复成红色;氯水表现氧化性,是因为含有HClO,HClO具有强氧化性,把有色氧化漂白,加热时不能恢复原来的颜色,因此加热装置D,无明显现象;
(3)SO2既有氧化性,也有还原性,SO2能将H2S氧化,则发生:SO2+2H2S=3S↓+2H2O,因此换成H2S溶液,通入SO2一段时间后,B中现象是溶液变浑浊,或有淡黄色沉淀生成;依据硫元素守恒,SO2→S,2H2S→2S,因此氧化产物与还原产物的物质的量之比为2:1;
(4)利用Cl2具有强氧化性,SO2以还原为主,两者1:1混合,Cl2将SO2氧化成H2SO4,即化学反应方程式为Cl2+SO2+2H2O=2HCl+H2SO4。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】同温同压下,等质量的SO2和CO2相比较,下列叙述中正确的是
A.密度比为1:1B.密度比为11∶16
C.体积比为11∶16D.体积比为16∶11
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 饱和Na2CO3溶液与CaSO4固体反应:CO32+CaSO4![]() CaCO3+SO42
CaCO3+SO42
B. 酸化NaIO3和NaI的混合溶液:I +IO3+6H+![]() I2+3H2O
I2+3H2O
C. KClO碱性溶液与Fe(OH)3反应:3ClO+2Fe(OH)3![]() 2FeO42+3Cl+4H++H2O
2FeO42+3Cl+4H++H2O
D. 电解饱和食盐水:2Cl+2H+![]() Cl2↑+ H2↑
Cl2↑+ H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于铝热剂和铝热反应的叙述错误的是
A.铝热剂的反应原理是利用铝的强还原性
B.铝热剂不只是指铝和氧化铁混合后的物质
C.铝热反应常用于冶炼高熔点金属
D.铝热反应需用镁带和氯酸钾引燃,所以铝热反应是一个吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚锡(SnSO4)是一种重要的硫酸盐,主要用于电镀工业的镀锡、铝合金表面的氧化着色、印染工业的媒染剂、双氧水去除剂等。某研究小组设计SnSO4制备路线如下:

查阅资料:
Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
Ⅱ.SnCl2易水解生成难溶物Sn(OH)Cl(碱式氯化亚锡)。
III.Sn(OH)2的性质与Al(OH)3性质相似。请回答下列问题:
(1)SnCl2粉末需加浓盐酸进行溶解,这样操作的原因是____________________。
(2)反应Ⅰ得到沉淀是SnO,得到该沉淀的离子方程式是____________________。
(3)滤液I溶质的成分是____________________。
(4)酸性条件下,SnSO4还可以用作双氧水去除剂,发生反应的离子方程式是____________________。
(5)称取SnSO4·x H2O晶体50.2g,在隔绝空气的情况下小火加热至结晶水全部失去,冷却称量固体质量为43g,则该晶体的化学式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是一种廉价的碳资源,其综合利用具有重要意义。回答下列问题。
(1)CO2可以被NaOH溶液捕获。若所得溶液pH=13,CO2主要转化为_______(写离子符号);若所得溶液c(HCO3-):c(CO32-)=2:1,溶液pH=______。(室温下,H2CO3的K1=4×10-7;K2=5×10-11)
(2)CO2与CH4经催化重整,制得合成气:CH4(g)+CO2(g) ![]() (2CO(g)+2H2(g)
(2CO(g)+2H2(g)
①已知上述反应中相关的化学键键能数据如下:
化学键 | C—H | C=O | H—H | C |
键能/kJ·mol-1 | 413 | 745 | 436 | 1075 |
则该反应的△H=___________。分别在VL恒温密闭容器A(恒容)、B(恒压,容积可变)中,加入CH4和CO2各1mol的混合气体。两容器中反应达平衡后放出或吸收的热量较多的是____________(填“A”或“B”)
②按一定体积比加入CH4和CO2,在恒压下发生反应,温度对CO和H2产率的影响如下图所示。此反应优选温度为900℃的原因是_______________。
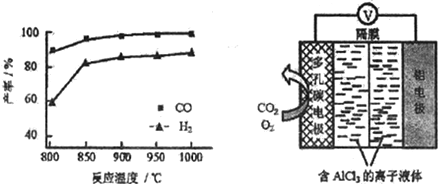
(3)O2辅助的A1-CO2电池工作原理如上图所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。
电池的正极反应式:6O2+6e-=6O2- 6CO2+6O2-=3C2O42-+6O2
反应过程中O2的作用是_______________。该电池的总反应式:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米级TiO2是一种光催化材料,可处理甲醛、氮氧化物等污染物,工业上也可用其催化乙醇脱氢制备乙醛:CH3CH2OH![]() CH3CHO + H2↑。
CH3CHO + H2↑。
(1)Ti原子基态核外电子排布式为____。
(2)CH3CHO分子中碳原子轨道的杂化类型是____,1 mol CH3CHO分子中含有 σ 键的数目为____。
(3)与NO互为等电子体的一种阳离子为____(填化学式)。
(4)乙醇可以与水以任意比互溶,除因为它们都是极性分子外,还因为____。
(5)一种TiO2的晶胞结构如图所示,其中与每个氧原子直接相连的钛原子数目为____。
 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知2H→H2放出437.6 kJ的热量,下列说法正确的是____
A.氢气分子内每个氢原子都达到稳定结构
B.氢气分子的能量比两个氢原子的能量低
C.1molH2离解成 2 mol H 要放出437.6 kJ热量
D.氢原子比氢气分子稳定
(2)科学家最近研制出利用太阳能产生激光,并在二氧化钛(TiO2)表面作用使海水分解得到氢气的新技术2H2O![]() 2H2↑+O2↑。制得的氢气可用于制作燃料电池.试回答下列问题:
2H2↑+O2↑。制得的氢气可用于制作燃料电池.试回答下列问题:
①分解海水时,实现了光能转化为__能;生成的氢气用于制作燃料电池时,实现了化学能转化为____能;分解海水的反应属于___反应(填“放热”或“吸热”)
②某种氢氧燃料电池是用固体金属氧化物陶瓷作电解质,A极上发生的电极反应为:2H2+2O24e=2H2O,则B极的电极反应式为:____
(3)已知某电池的总反应为:Zn+2MnO2+2NH4Cl=ZnCl2+2NH3↑+Mn2O3+H2O,写出该电池的电极反应方程式:负极_______正极_______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com