
【题目】同温同压下,等质量的SO2和CO2相比较,下列叙述中正确的是
A.密度比为1:1B.密度比为11∶16
C.体积比为11∶16D.体积比为16∶11
 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】为了防止金属氧化,宋老师想了很多办法,她发现有些活泼金属在空气中易与氧气反应,表面生成一层致密的氧化膜,可以保护内层金属不被继续氧化的是( )
①铁 ②钠 ③铝 ④镁
A. ①② B. ②③ C. ③④ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向 100mL Na2CO3 与 NaAlO2 的混合溶液中逐滴加入 1mol/L 的盐酸,测得溶液中的 CO32-、HCO3- 、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示。下列说法正确的是
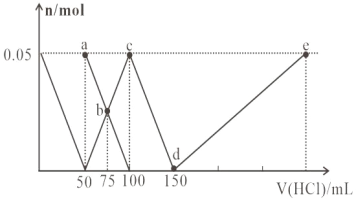
A. 原 混 合 溶 液 中 的 n (CO32-): n (AlO2-)=2:1
B. a 点溶液中:c(HCO3-)+c(H2CO3)+c(H+)=c(OH-)
C. b 点溶液中离子浓度顺序为:c(Cl-)>c(HCO3-)>c(CO32-)>c(OH- )
D. d→e 的过程中水的电离程度逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铁溶液与氢氧化铁胶体的共同点是 ( )
A.分散质颗粒直径都在l~100nm之间
B.用一束平行光照射时,从侧面都可以看到一束光束
C.颜色都呈红褐色
D.都是分散系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硅孔雀石[主要成分为CuCO3·Cu(OH)2、CuSiO3·2H2O,含SiO2、FeCO3、Fe2O3等杂质]为原料制备CuCl2的工艺流程如下:

已知:SOCl2+H2O![]() SO2↑+2HCl↑
SO2↑+2HCl↑
(1)“酸浸”时盐酸与CuCO3·Cu(OH)2反应的化学方程式为_________________。
检验“酸浸”后浸出液中的Fe3+可用____________溶液。
(2)“氧化”时发生反应的离子方程式为____________________________。
(3)“滤渣2”的主要成分为________(填化学式);“调pH”时,pH不能过高,其原因是________________。
(4)“加热脱水”时,加入SOCl2的目的是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,蜂胶已成为保健品的宠儿,其主要成分CAPE(咖啡酸苯乙酯)因具有极强的抗炎和抗氧化活性得以在食品、医学以及其他领域广泛应用。通过下列途径可合成咖啡酸苯乙酯。

已知:A的核磁共振氢谱(1HNMR)显示,分子中有4种不同化学环境的氢原子,A能与FeCl3溶液发生显色反应。
(1)丙二酸的结构简式为________________。
(2)咖啡酸苯乙酯含有的含氧官能团名称为_________________________。
(3)咖啡酸苯乙酯的分子式为________________,D的结构简式为____________________。
(4)反应类型:B―→C______________。
(5)A―→B的化学方程式为_______________________________________________________。
(6)写出同时满足下列条件的C的所有同分异构体的结构简式(不考虑立体异构):________________。
a.属于酯类
b.能发生银镜反应
c.与FeCl3溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关从海带中提取碘的实验原理和装置能达到实验目的的是

A. 用装置甲灼烧碎海带
B. 用装置乙过滤海带灰的浸泡液
C. 用装置丙制备用于氧化浸泡液中I的Cl2
D. 用装置丁吸收氧化浸泡液中I后的Cl2尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下图所示装置检验草酸亚铁晶体(FeC2O42H2O,淡黄色)受热分解的部分产物。下列说法正确的 是( )
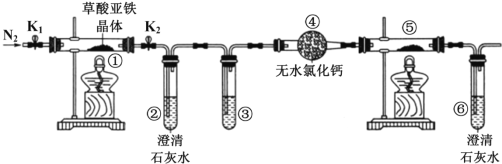
A. 通入N2 的主要目的是防止空气中的水蒸气对产物检验产生影响
B. 若将④中的无水 CaC12 换成无水硫酸铜可检验分解生成的水蒸气
C. 若检验有 CO 生成,③和⑤中分别盛放足量NaOH 溶液、CuO
D. 实验结束后,①中淡黄色粉末完全变成黑色,则产物一定为铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。

(1)实验室用装置A制备SO2,某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未流下,可能的原因是_____________(合理均可);C装置的作用___________________。
(2)反应开始一段时间后,观察到B、D两个试管中的品红溶液都褪色,停止通气后,再给B、D两个试管分别加热;两个试管中的现象分别为:B:_______________,D:________________。
(3)若将B中品红换成H2S溶液,通SO2一段时间后B中现象为_____,该反应的化学方程式为______,其中氧化产物与还原产物的物质的量之比为________。
(4)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强。他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示)___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com