
I.下列分子中,立体构型是平面三角形的是_____。
A.CH4 B.NH3 C.BF3 D.SO3
II.氟及氟产品在工农业生产中应用非常广泛,回答下列问题:
(1)基态氟原子核外电子的运动状态有______种,这些电子的电子云形状有______种;氟原子的外围电子排布式为________。
(2)NaHF2(氟化氢钠)电解可制氟气,NaHF2中所含作用力的类型有____;与HF2-互为等电子体的分子有______(举一例)。
(3)C2F4分子中,碳原子的杂化轨道类型为________。
(4)三氟化硼乙醚( )的熔点为-58℃,沸点为126~129℃,它属于_____晶体。
)的熔点为-58℃,沸点为126~129℃,它属于_____晶体。
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源:2016届陕西省高三上学期第二次模拟理综化学试卷(解析版) 题型:推断题
下列有机化合物转化关系如图所示:

已知:(1)
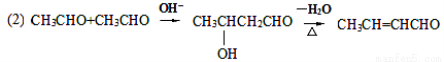
其中化合物A苯环上的一氯代物只有两种。请回答下列问题:
(1)写出A的结构简式 。
(2)B中含有的官能团的名称 。
(3)①、③的反应类型分别为 ;化合物F的核磁共振氢谱显示有 个峰。
(4)写出C与新制Cu(OH)2反应的化学方程式_________________________________。
(5)已知两分子H能形成六元环酯, 写出反应③的化学方程式 。
(6)化合物C有多种同分异构体,请写出其中满足下列条件的所有同分异构体的结构简式 。
①遇氯化铁溶液显紫色;②苯环上有三个取代基;③苯环上的一氯取代物只有两种。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年上海市高二上学期期中测试化学试卷(解析版) 题型:选择题
下列关于铝热剂的有关叙述中正确的是:
A.利用铝热剂的反应,常用于冶炼高熔点的金属
B.氧化铝和铁的混合物是铝热剂
C.铝热剂发生的铝热反应需要用镁带和氯酸钾引燃,所以铝热反应是吸热反应
D.工业上常用铝热反应来大量冶炼金属铁
查看答案和解析>>
科目:高中化学 来源:2016届宁夏育才中学高三上学期第四次月考化学试卷(解析版) 题型:选择题
在化学反应中,有时存在“一种物质过量,另一种物质仍不能完全反应”的情况,下列反应中属于这种情况的是( )
①过量的锌与浓硫酸反应;②过量的氢气与少量的N2在工业生产条件下反应;③过量的浓盐酸与碳酸钙反应;④过量二氧化锰与浓盐酸在加热条件下反应;⑤过量的铜与浓硫酸在加热条件下反应
A.②③④ B.②④⑤ C.①②④ D.③④⑤
查看答案和解析>>
科目:高中化学 来源:2016届湖北武汉华中师大一附中等八校高三上联考一理化学卷解析版 题型:填空题
E、G、M、Q、T是五种原子序数依次增大的前四周期元素。E、G、M是位于P区的同一周期的元素,M的价层电子排布为nsnnp2n,E与M原子核外的未成对电子数相等;QM2与GM2-为等电子体;T为过渡元素,其原子核外没有未成对电子。请回答下列问题:
(1)与T同区、同周期元素原子价电子 排布式是 。
排布式是 。
(2)E、G、M均可与氢元素形成氢化物,它们的最简单氢化物在固态时都形成分子晶体,其中晶胞结构与干冰不一样的是 (填分子式)。
(3)E、G、M的最简单氢化物中,键角由大到小的顺序为 (用分子式表示),其中G的最简单氢化物的VSEPR模型名称为 ,M的最简单氢化物的分子立体构型名称为 。
(4)EM、GM+、G2互为等电子体,EM的结构式为(若有配位键,请用“→”表示) 。E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因 。
(5)TQ在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方TQ晶体结构如图所示,该晶体的密度为ρ g·cm-3。如果TQ的摩尔质量为M g/mol,阿伏加德罗常数为NA mol-1,则a、b之间的距离为 cm。
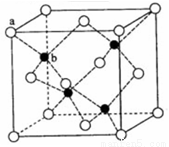
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江余姚中学高一上学期期中考试化学试卷(解析版) 题型:选择题
化学兴趣小组在家中进行化学实验,按照图一连接好线路发现灯泡不亮,按照图二连接好线路发现灯泡亮,由此得出的结论正确的是

A.NaCl是非电解质
B.NaCl溶液是电解质[来
C.NaCl固体中不存在带电离子
D.NaCl的水溶液中存在可自由移动的带电微粒
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江台州中学高二上第三次统练化学试卷(解析版) 题型:简答题
25℃时,有关物质的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | H2SO3 |
电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
(1)三种酸由强至弱的顺序为 (用化学式表示)。
(2)常温下,0.02 mol·L-1的CH3COOH溶液的电离度约为 ,体积为10 mL pH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者 后者(填“>”、“<”或“=”)。
(3)下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+能力由大到小为 。
(4)c(NH4+)相同的下列物质的溶液中,物质的量浓度最大的是 。
A.NH4Al(SO4)2 B.NH4HCO3 C.NH4HSO4 D.NH4NO3 E.CH3COONH4
(5)等浓度的CH3COONa、NaHCO3的混合溶液中,各离子浓度关系正确的是 。
A.c(CH3COO-)>c(HCO3-)>c(OH-)
B.c(Na+)+c(H+) = c(CH3COO-)+c(HCO3-)+c (OH-)
(OH-)
C.c(OH-)>c(HCO3-)>c(CH3COO-)
D.c(CH3COO-)+c(CH3COOH) = c(HCO3-)+c(CO32-)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南衡阳第八中学高一上六科联赛化学卷(解析版) 题型:选择题
下列变化需加入氧化剂才能实现的是
A.CaCO3 →CO2 B.KMnO4 → O2 C.HCl → Cl2 D.H2SO4 → H2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高二上期中考试化学试卷(解析版) 题型:选择题
下列各表述与示意图一致的是( )
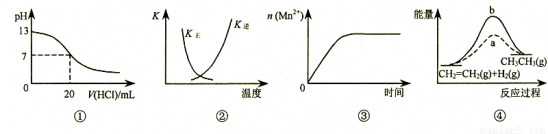
A.图②中曲线表示反应2SO2(g) + O2(g)  2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化
2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化
B.图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化
C.图③表示10 mL 0.01 mol·L-1 KMnO4酸性溶液与过量的0.1 mol·L-1 H2C2O4溶液混合时,n(Mn2+) 随时间的变化
D.图④中a、b曲线分别表示反应CH2=CH2 (g) + H2(g) CH3CH3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化
CH3CH3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com