
【题目】雾霾天气严重影响了人们的身体健康,环境问题越来越受到人们的重视。汽车尾气中含有较多的NO和CO,两种气体均会使人体中毒。处理大气中的污染物,打响“蓝天白云”保卫战是当前的重要课题。
请回答下列问题
(1)一氧化碳、氢气既是重要的能源,也可以催化还原NO等消除污染,还可以在一定条件下制取CH3OH。
已知:①N2(g)+O2(g)=2NO(g) △H=+180.5kJ·mol-1;
②2H2(g)+O2(g)=2H2O(1) △H=-571.6kJ·mol-1;
③H2O(g)=H2O(1) △H=-44kJ·mol-1。
写出H2与NO反应生成N2和水蒸气的热化学方程式:__。
(2)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)![]() CH3OH(g)。在密闭容器中充有10molCO和20molH2,在催化剂作用下发生反应生成甲醇,改变条件,测得CO的平衡转化率与温度(T)、压强(p)的关系如图所示。则该反应的△H___0(填“>”或“<”)。若达到平衡状态A时,容器的体积为10L,则在平衡状态B时平衡常数K=___。
CH3OH(g)。在密闭容器中充有10molCO和20molH2,在催化剂作用下发生反应生成甲醇,改变条件,测得CO的平衡转化率与温度(T)、压强(p)的关系如图所示。则该反应的△H___0(填“>”或“<”)。若达到平衡状态A时,容器的体积为10L,则在平衡状态B时平衡常数K=___。

(3)工业上采用加压条件下,在含冷却装置的吸收塔中,以去离子水为吸收剂吸收NO,得到40%的硝酸。原理如下:
2NO(g)+O2(g)![]() 2NO2(g) △H=-114kJ·mol-1
2NO2(g) △H=-114kJ·mol-1
3NO2(g)+H2O(l)![]() 2HNO3(aq)+NO(g) △H=-69.92kJ·mol-1
2HNO3(aq)+NO(g) △H=-69.92kJ·mol-1
采用降温操作的一个原因是__。
(4)利用电解原理也可以处理工厂烟气。如图为工业生产模拟装置。其中A、B为多孔电极(外接电源未画出),则A为___极(填“正”“负”“阴”或“阳”),电极反应式为___。
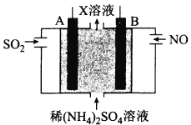
【答案】2H2(g)+2NO(g)=2H2O(g)+N2(g) △H=-664.1kJ![]() mol-1 < 1 降低温度平衡正向移动,硝酸高温下易分解 阳极 SO2-2e-+2H2O=SO
mol-1 < 1 降低温度平衡正向移动,硝酸高温下易分解 阳极 SO2-2e-+2H2O=SO![]() +4H+
+4H+
【解析】
(1)已知:①N2(g)+O2(g)=2NO(g) △H=+180.5kJ·mol-1;②2H2(g)+O2(g)=2H2O(1) △H=-571.6kJ·mol-1;③H2O(g)=H2O(1) △H=-44kJ·mol-1。根据盖斯定律①-②-2×③得2H2(g)+2NO(g)=2H2O(g)+N2(g)△H=-664.1kJ·mol-1;故答案为:2H2(g)+2NO(g)=2H2O(g)+N2(g)△H=-664.1kJ·mol-1;
(2)根据图可知,随着温度的升高,CO的转化率降低,说明温度升高不利于正反应,即该反应是放热反应,△H<0;
平衡状态A时,CO的转化率为0.5,容器的体积为10L,则有三段式:

则T1时,K=![]() =1,平衡状态B与A温度相同,则K不变。
=1,平衡状态B与A温度相同,则K不变。
故答案为:<;1;
(3)根据反应可知,以去离子水吸收剂吸收NO的反应为放热反应,硝酸高温下易分解,故采用降温操作可以促进反应的进行同时防止硝酸的分解;故答案为:降低温度平衡正向移动,硝酸高温下易分解;
(4)根据图示,总反应为:5SO2+2NO+8H2O=(NH4)2SO4+4H2SO4,则X溶液中的溶质是(NH4)2SO4、H2SO4;A极SO2失去电子发生氧化反应生成SO42-,则A为阳极,电极反应为:SO2-2e-+2H2O=SO![]() +4H+。故答案为:阳;SO2-2e-+2H2O=SO
+4H+。故答案为:阳;SO2-2e-+2H2O=SO![]() +4H+。
+4H+。


 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:
【题目】面对目前世界范围内的能源危机,甲醇作为一种较好的可再生能源,具有广泛的应用前景。
(1)已知在常温常压下反应的热化学方程式:
①CO(g)+2H2(g)![]() CH3OH(g) ΔH1=-90 kJ·mol-1
CH3OH(g) ΔH1=-90 kJ·mol-1
②CO(g)+H2O(g)![]() CO2(g)+H2(g)ΔH2=-41 kJ·mol-1
CO2(g)+H2(g)ΔH2=-41 kJ·mol-1
写出由二氧化碳、氢气制备甲醇的热化学方程式:_______________________。
(2)在容积为VL的容器中充入amol CO与2amol H2,在催化剂作用下反应生成甲醇,平衡时的转化率与温度、压强的关系如图所示。
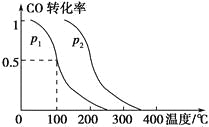
①p1________p2(填“大于”、“小于”或“等于”);
②在其他条件不变的情况下,再增加amol CO与2amol H2,达到新平衡时,CO的转化率________(填“增大”、“减小”或“不变”,下同),平衡常数________。
(3)已知在T℃时,CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1 mol·L-1,c始(H2O)=1 mol·L-1,某时刻经测定CO的转化率为10%,则该反应________(填“已经”或“没有”)达到平衡,原因是_________________________________,此时刻υ正________υ逆(填“>”或“<”)。
CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1 mol·L-1,c始(H2O)=1 mol·L-1,某时刻经测定CO的转化率为10%,则该反应________(填“已经”或“没有”)达到平衡,原因是_________________________________,此时刻υ正________υ逆(填“>”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组设计如图装置(部分夹持装置已略去),以探究潮湿的Cl2与Na2CO3反应得到固体物质的成分。
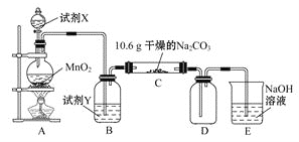
(1)试剂X的化学式________。A中制取Cl2的离子方程式____________________。
(2)试剂Y的名称为______________。
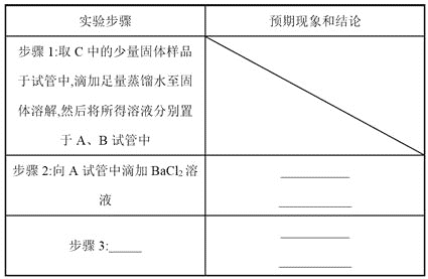
(3)通入一定量潮湿的Cl2反应后,经检测,D中只有Cl2O一种气体,C中除含一种氯盐外,同时含有NaHCO3等,某同学对C中所得固体残渣的成分进行探究。
①提出合理假设。
假设1:存在两种成分:NaHCO3和____________________________;
假设2:存在三种成分:NaHCO3和__________________________。
②设计方案,进行实验。写出实验步骤以及预期现象和结论。_______
限选实验试剂和仪器:蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。
(4)已知Cl2O与水反应生成次氯酸,则D中Cl2O进入E反应的化学方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Cu(s)+2H+(aq)===Cu2+(aq)+H2(g) ΔH1
2H2O2(l)===2H2O(l)+O2(g) ΔH2
2H2(g)+O2(g)===2H2O(l) ΔH3
则反应Cu(s)+H2O2(l)+2H+(aq)===Cu2+(aq)+2H2O(l)的ΔH是
A. ΔH=ΔH1+1/2ΔH2+1/2ΔH3 B. ΔH=ΔH1+1/2ΔH2-1/2ΔH3
C. ΔH=ΔH1+2ΔH2+2ΔH3 D. ΔH=2ΔH1+ΔH2+ΔH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向10mL0.1molL-1HX溶液中逐滴加入0.2molL-1YOH溶液,混合溶液的pH变化情况如图所示(温度和体积变化忽略不计)。则下列结论错误的是( )
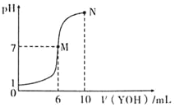
A.HX为一元强酸,YOH为一元弱碱
B.M点水的电离程度大于N点水的电离程度
C.N点对应溶液中粒子浓度:c(YOH)>c(Y+)>c(X-)>c(H+)>c(OH-)
D.25℃时pH=a的YX溶液中水电离出的c(H+)=1.0×10-amolL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.2 mol·L-1的KI溶液和0.05 mol·L-1Fe2(SO4)3溶液等体积混合后,取混合液分别完成下列实验,能说明溶液中存在化学平衡“2Fe3++2I-![]() 2Fe2++I2”的是( )
2Fe2++I2”的是( )
实验编号 | 实验操作 | 实验现象 |
① | 滴入KSCN溶液 | 溶液变红色 |
② | 滴入AgNO3溶液 | 有黄色沉淀生成 |
③ | 滴入K3[Fe(CN)6]溶液 | 有蓝色沉淀生成 |
④ | 滴入淀粉溶液 | 溶液变蓝色 |
已知:离子方程式:3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓(蓝色沉淀)
A.①B.②和④C.③和④D.①和②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硫酸盐是一种常见的食品添加剂,用如下图实验可检验某食品中亚硫酸盐含量(所加试剂均足量)。下列说法不正确的是

A.亚硫酸盐作为食品添加剂,作用是防腐保鲜
B.反应①过程中通入N2的作用是将装置中空气和生成的气体全部赶出
C.测定样品质量及③中耗碱量,可测定样品中亚硫酸盐含量
D.若仅将②中的氧化剂“H2O2溶液”替换为碘水,对测定结果无影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:p=p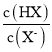 =-lg
=-lg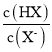 。室温下,向0.10mo1·L-1的HX溶液中滴加0.1mol·L-1的NaOH溶液,溶液pH随p的变化关系如图。下列说法正确的是( )
。室温下,向0.10mo1·L-1的HX溶液中滴加0.1mol·L-1的NaOH溶液,溶液pH随p的变化关系如图。下列说法正确的是( )

A.a点溶液中:c(HX)+c(X-)=0.10mo1·L-1
B.c点溶液中:c(Na+)<10c(HX)
C.b点坐标为(0,4.50)
D.溶液中水的电离程度:c<b<a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将稀HCl溶液滴加到等浓度的弱碱AOH溶液中,测得混合液的pH和![]() 的关系如图所示,其中a点表示未加盐酸时的数据,e点表示HCl和AOH恰好完全反应时的数据。下列说法错误的是( )
的关系如图所示,其中a点表示未加盐酸时的数据,e点表示HCl和AOH恰好完全反应时的数据。下列说法错误的是( )
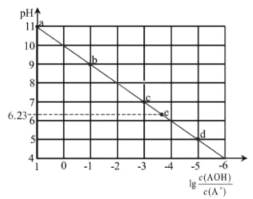
A.常温下,A+的水解平衡常数为1.0×10-10
B.点d溶液中:c(Cl-)> c(AOH)>c(A+)
C.点c 溶液中的n(A+)+n(AOH)等于点e溶液中的n(Cl-)
D.点e溶液中水电离出的H+浓度为10-6.23 mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com