
【题目】室温下,向10mL0.1molL-1HX溶液中逐滴加入0.2molL-1YOH溶液,混合溶液的pH变化情况如图所示(温度和体积变化忽略不计)。则下列结论错误的是( )
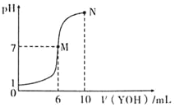
A.HX为一元强酸,YOH为一元弱碱
B.M点水的电离程度大于N点水的电离程度
C.N点对应溶液中粒子浓度:c(YOH)>c(Y+)>c(X-)>c(H+)>c(OH-)
D.25℃时pH=a的YX溶液中水电离出的c(H+)=1.0×10-amolL-1
【答案】C
【解析】
A.根据图示可知,0.1mol·L-1的HX溶液的pH=1,说明HX完全电离,为一元强酸;滴入6mL0.2mol·L-1YOH溶液时,YOH过量,溶液的pH=7,说明YOH为一元弱碱,故A正确,不选;
B.M点溶质为YX、YOH,溶液的pH=7,水的电离程度不变,而N点加入10mLYOH溶液,溶液的pH=10,抑制了水的电离,所以M点水的电离程度大于N点水的电离程度,故B正确,不选;
C.N点溶液呈碱性,则c(OH-)>c(H+),结合电荷守恒可知:c(Y+)>c(X-),N点溶液中存在物料守恒:c(Y+)+c(YOH)=2c(X-),则c(Y+)>c(X-)>c(YOH),正确的粒子浓度大小为:c(Y+)>c(X-)>c(YOH)>c(OH-)>c(H+),故C错误,符合题意;
D.YX为强酸弱碱盐,Y+离子水解溶液呈酸性,促进了水的电离,溶液中氢离子主要来自水的电离,25℃时pH=a的YX溶液中水电离出的c(H+)=1.0×10-amol·L-1,故D正确,不选;
故选C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】把在空气中久置的镁条7.2 g投入盛有500 mL 0.5 mol·L-1硫酸溶液的烧杯中,镁条与硫酸反应产生氢气的速率与反应时间如图所示,回答下列问题:
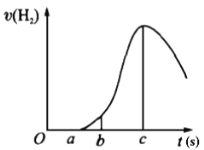
(1)曲线由0→a段不产生氢气的原因________,有关的离子方程式为______________;
(2)曲线由b→c段,产生氢气的速率逐渐增大的主要原因________________;
(3)曲线由c以后,产生氢气的速率逐渐下降的主要原因________________。
(4)在b到c这段时间内,收集到氢气V L(标准状况),则这段时间内用硫酸表示的平均速率为________mol/(L·s)(假设反应前后溶液体积不变)。
(5)对于足量镁条和100 mL 2 mol/L硫酸生成氢气的反应,下列措施能减缓反应速率,但又不影响生成氢气的总量的是________。
①加NaOH固体;②加BaCl2溶液;③加KNO3溶液;④加H2O;⑤加CH3COONa固体;⑥加小苏打溶液;⑦加少量CuSO4溶液;⑧加Na2SO4溶液;⑨将2 mol/L硫酸换成160 mL 2.5 mol/L的盐酸;⑩将镁条换成镁粉。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中A~L分别代表中学化学中的常见物质(部分反应的条件已略去)。A是一种常见氮肥,摩尔质量为79 g·mol-1。常温下,C是无色液体,E、L为常见金属单质,B、G、I、J、K为气体,其中D能使澄清的石灰水变浑浊,K呈红棕色。F为有磁性的黑色固体。
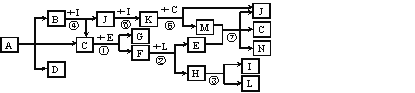
(1)A的化学式为____。
(2)写出反应④的化学方程式:____。
(3)写出反应①的化学方程式:____。
(4)若反应⑦中物质E过量,写出该反应的离子方程式:____。
(5)气体B或K直接排放到空气中会污染环境,在催化剂作用下两者会反应生成对环境无害的物质。写出该反应的方程式,并用单线桥表示电子转移的方向和数目:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D同族,C离子和B离子具有相同的电子层结构。A和B、D、E均能形成共价型化合物。A和B形成的化合物在水中呈碱性,C和E形成的化合物是日常生活中的常用调味品。回答下列问题:
(1)五种元素中,原子半径最大的是________,非金属性最强的是________(填元素符号)。
(2)由A分别和B、D、E所形成的共价型化合物中,热稳定性最差的是__________(用化学式表示)。
(3)A、B、E形成的离子化合物电子式为____________,其中存在的化学键类型为____________。
(4)D最高价氧化物的水化物的化学式为________________。
(5)单质D在充足的单质E中燃烧,反应的化学方程式为__________________;D在不充足的E中燃烧,生成的主要产物的化学式为__________。
(6)单质E与水反应的离子方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.使用催化剂能够降低化学反应的反应热△H
B.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)的ΔH=+2×283.0kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和NH3.H2O反应的中和热ΔH=2(-57.3)kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾天气严重影响了人们的身体健康,环境问题越来越受到人们的重视。汽车尾气中含有较多的NO和CO,两种气体均会使人体中毒。处理大气中的污染物,打响“蓝天白云”保卫战是当前的重要课题。
请回答下列问题
(1)一氧化碳、氢气既是重要的能源,也可以催化还原NO等消除污染,还可以在一定条件下制取CH3OH。
已知:①N2(g)+O2(g)=2NO(g) △H=+180.5kJ·mol-1;
②2H2(g)+O2(g)=2H2O(1) △H=-571.6kJ·mol-1;
③H2O(g)=H2O(1) △H=-44kJ·mol-1。
写出H2与NO反应生成N2和水蒸气的热化学方程式:__。
(2)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)![]() CH3OH(g)。在密闭容器中充有10molCO和20molH2,在催化剂作用下发生反应生成甲醇,改变条件,测得CO的平衡转化率与温度(T)、压强(p)的关系如图所示。则该反应的△H___0(填“>”或“<”)。若达到平衡状态A时,容器的体积为10L,则在平衡状态B时平衡常数K=___。
CH3OH(g)。在密闭容器中充有10molCO和20molH2,在催化剂作用下发生反应生成甲醇,改变条件,测得CO的平衡转化率与温度(T)、压强(p)的关系如图所示。则该反应的△H___0(填“>”或“<”)。若达到平衡状态A时,容器的体积为10L,则在平衡状态B时平衡常数K=___。

(3)工业上采用加压条件下,在含冷却装置的吸收塔中,以去离子水为吸收剂吸收NO,得到40%的硝酸。原理如下:
2NO(g)+O2(g)![]() 2NO2(g) △H=-114kJ·mol-1
2NO2(g) △H=-114kJ·mol-1
3NO2(g)+H2O(l)![]() 2HNO3(aq)+NO(g) △H=-69.92kJ·mol-1
2HNO3(aq)+NO(g) △H=-69.92kJ·mol-1
采用降温操作的一个原因是__。
(4)利用电解原理也可以处理工厂烟气。如图为工业生产模拟装置。其中A、B为多孔电极(外接电源未画出),则A为___极(填“正”“负”“阴”或“阳”),电极反应式为___。
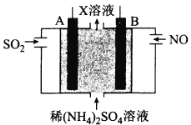
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,向2 L的密闭容器中充入一定量的A和B,发生反应:A(g)+B(g) ![]() C(s)+xD(g) ΔH>0,容器中A、B、D的物质的量随时间的变化如图所示。下列说法正确的是( )
C(s)+xD(g) ΔH>0,容器中A、B、D的物质的量随时间的变化如图所示。下列说法正确的是( )
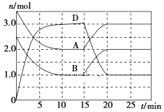
A.反应在前10 min内的平均反应速率v(D)=0.3mol·L-1·min-1
B.若平衡时保持温度不变,压缩容器体积,平衡向逆反应方向移动,平衡常数K值减小
C.反应至15min时,其他条件不变,改变的条件可能是缩小容器体积
D.反应至15min时,其他条件不变,改变的条件可能是降低反应体系温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】仅用下表提供的用品(夹持仪器和试剂任选)能实现相应实验目的的是( )
选项 | 实验目的 | 仪器 |
A | 从食盐水中获得NaCl晶体 | 坩埚、玻璃棒、酒精灯、泥三角 |
B | 除去氢氧化铝胶体中的泥沙 | 半透膜、烧杯、玻璃棒 |
C | 用0.1000mol/L盐酸测定未知浓度的NaOH溶液浓度 | 碱式滴定管、酸式滴定管、锥形瓶、胶头滴管、烧杯 |
D | 中和热的测定 | 烧杯、温度计、环形玻璃搅拌棒、泡沫塑料、硬纸板 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式属于水解反应方程式的是( )
A.H2CO3![]() HCO3-+H+B.HCO3-+H2O
HCO3-+H+B.HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
C.HCO3-+OH-=H2O+CO32-D.CO32-+H2O![]() HCO3-+OH-
HCO3-+OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com