
【题目】下面是某课外小组从初选后的方铅矿(主要成分PbS,含少量黄铜矿(CuFeS2))中提取硫磺、铜、铅的工艺流程:
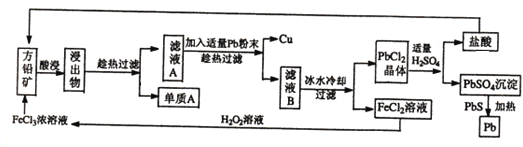
已知:CuFeS2+4FeCl3=2S+5FeCl2+CuCl2 、PbS+2FeCl3=S+PbCl2+2FeCl2
(1)黄铜矿( CuFeS2 )中Fe元素的化合价为 ______ ,提高方铅矿酸浸效率的措施有 ______ (写出两种方法即可)。
(2)过滤过程中用到的玻璃仪器有烧杯、玻璃棒、 ______ ;单质A是 ______ ,在此工艺操作中可循环利用的物质有铅和 ______ 。
(3)在酸性的FeCl2溶液中加入H2O2溶液,其反应的离子方程式为 ______ 。
(4)PbSO4与PbS加热条件下反应的化学方程式为 ______ 。
将沉淀PbSO4与足量的碳酸钠溶液混合,沉淀可转化可转化为PbCO3,写出该反应的平衡常数表达式:K= ______ 。(已知Ksp(PbSO4)=1.6×10-5,Ksp(PbCO3)=3.3×10-14)
(5)铅蓄电池的电极材料分别是Pb和PbO2,电解质溶液为硫酸;铅蓄电池充放电的总反应方程式为:PbO2+Pb+2H2SO4![]() 2PbSO4+2H2O,充电时,铅蓄电池阳极的电极反应式为 ______ 。
2PbSO4+2H2O,充电时,铅蓄电池阳极的电极反应式为 ______ 。
【答案】+2 搅拌,适当提高酸的浓度,加热,将矿石粉碎,延长浸取时间等 漏斗 S 盐酸和氯化铁溶液 2Fe2++H2O2+2H+=2Fe3++2H2O PbSO4+PbS![]() 2Pb+2SO2↑
2Pb+2SO2↑ 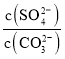 PbSO4-2e-+2H2O=PbO2+SO42-+4H+
PbSO4-2e-+2H2O=PbO2+SO42-+4H+
【解析】
方铅矿中加入氯化铁溶液酸浸,发生氧化还原反应生成S,过滤,单质A为S,滤液A中含有FeCl2、CuCl2以及PbCl2等,加入适量Pb粉可置换出铜,滤液B中含有FeCl2、PbCl2等,经冷水冷却,过滤可得到PbCl2晶体,加入适量硫酸可生成盐酸和硫酸铅,其中盐酸循环使用,硫酸铅中加入PbS发生氧化还原反应生成Pb和二氧化硫气体,FeCl2溶液中加入过氧化氢,发生氧化还原反应生成FeCl3,可循环使用。
(1)CuFeS2中Cu为+2价,S为-2价,则Fe元素的化合价为+2价,方铅矿酸浸为固体和溶液的反应,为提高反应的速率,可加热、增大溶液浓度、增大固体的接触面积或搅拌等,故答案为:+2;搅拌,适当提高酸的浓度,加热,将矿石粉碎,延长浸取时间等;
(2)过滤过程中用到的玻璃仪器有烧杯、玻璃棒、漏斗,由以上分析可知单质A是S,在此工艺操作中可循环利用的物质有铅和盐酸、氯化铁溶液,
故答案为:漏斗;S;盐酸和氯化铁溶液;
(3)FeCl2溶液中加入过氧化氢,发生氧化还原反应生成FeCl3,反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(4)硫酸铅中加入PbS发生氧化还原反应生成Pb和二氧化硫气体,反应的化学方程式为PbSO4+PbS![]() 2Pb+2SO2↑,PbSO4转化为PbCO3的反应为PbSO4(s)+CO32-
2Pb+2SO2↑,PbSO4转化为PbCO3的反应为PbSO4(s)+CO32-![]() PbCO3(s)+SO42-,该反应平衡常数表达式K=
PbCO3(s)+SO42-,该反应平衡常数表达式K=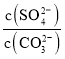 ,
,
故答案为:PbSO4+PbS![]() 2Pb+2SO2↑;
2Pb+2SO2↑;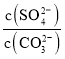 ;
;
(5)充电时,阳极上PbSO4失电子发生氧化反应,电极反应式为PbSO4-2e-+2H2O=PbO2+SO42-+4H+,
故答案为:PbSO4-2e-+2H2O=PbO2+SO42-+4H+。


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:
【题目】工业废气、汽车尾气排放出的SO2、NOx等,是形成雾霾的重要因素.霾是由空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾.
(1)SO2在烟尘的催化下形成硫酸的反应方程式是______________.
(2)NOx和SO2在空气中存在下列平衡:
2NO(g)+O2(g)2NO2(g)△H=﹣113.0kJmol﹣1
2SO2(g)+O2(g)2SO3(g)△H=﹣196.6kJmol﹣1
SO2通常在二氧化氮的存在下,进一步被氧化,生成SO3.
①写出NO2和SO2反应的热化学方程式为_________.
②随温度升高,该反应化学平衡常数变化趋势是_____.
(3)提高2SO2+O22SO3反应中SO2的转化率,是减少SO2排放的有效措施.
①T温度时,在1L的密闭容器中加入2.0mol SO2和1.0mol O2,5min后反应达到平衡,二氧化硫的转化率为50%,该反应的平衡常数是____.
②在①中条件下,反应达到平衡后,改变下列条件,能使SO2的转化率提高的是_____(填字母).
a.温度和容器体积不变,充入1.0mol He b.温度和容器体积不变,充入1.0mol O2
c.在其他条件不变时,减少容器的体积 d.在其他条件不变时,改用高效催化剂
e.在其他条件不变时,升高体系温度
(4)工业上利用氯碱工业产品治理含二氧化硫的废气.如图是氯碱工业中电解饱和食盐水的原理示意图。

①电解饱和食盐水的化学方程式是________________.
②用溶液A吸收含二氧化硫的废气,其反应的离子方程式是_________.
③用含气体B的阳极区溶液吸收含二氧化硫的废气,其反应的离子方程式是___________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为了制取并探究氨气的性质,按下图装置进行实验,制取氨气的原理:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O,下列说法不正确的是( )
CaCl2+2NH3↑+2H2O,下列说法不正确的是( )
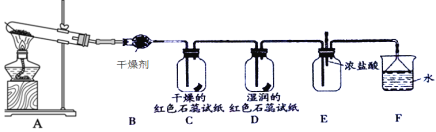
A.装置B中的干燥剂可以是P2O5B.装置C中的试纸不变色,D中试纸变蓝色
C.在装置E中滴入几滴浓盐酸会出现白烟D.装置F中的漏斗能起防倒吸作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯酸钠(NaClO2)是重要漂白剂。探究小组开展如下实验,回答下列问题:
实验Ⅰ:制取NaClO2晶体按下图装置进行制取。

已知:NaClO2饱和溶液在低于38℃时析出NaClO23H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
(1)用50%双氧水配制30%的H2O2溶液,需要的玻璃仪器除玻璃棒、胶头滴管、烧杯外,还需要________(填仪器名称);
(2)装置C的作用是_____________________________;
(3)装置B内生成的ClO2气体与装置D中混合溶液反应生成NaClO2,生成NaClO2的反应方程式为______________________________________。
(4)如果撤去D中的冷水浴,可能导致产品中混有的杂质是___________________;
(5)反应后,经以下步骤可从装置D的溶液获得NaClO2晶体。请补充完整操作③。
①55℃蒸发结晶; ②趁热过滤; ③___________;④低于60℃干燥,得到成品。
实验Ⅱ:样品杂质分析与纯度测定
(6)上述实验制得的NaClO2晶体中含少量Na2SO4。产生Na2SO4最可能的原因是______;
a.B中有SO2气体产生,并有部分进入D装置内
b.B中浓硫酸挥发进入D中与NaOH中和
c.B中的硫酸钠进入到D装置内
(7)测定样品中NaClO2的纯度。测定时进行如下实验:
准确称一定质量的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:ClO2-+ 4I-+4H+ =2H2O+2I2+Cl-,将所得混合液稀释成100mL待测溶液。取25.00mL待测溶液,加入淀粉溶液做指示剂,用c mol·L-1 Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL(已知:I2 +2S2O32-=2I-+S4O62-)。
①确认滴定终点的现象是_________________;
②所称取的样品中NaClO2的物质的量为_______________(用含c、V的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校学生化学实验小组,为验证非金属元素氟的氧化性强于硫和氮,设计了一套实验装置:(部分加持装置已略去)
(1)写出A中反应的离子方程式 。
(2)B中出现黄色浑浊现象,产生此现象的离子方程式 。
(3)试从原子结构角度解释氯的氧化性大于硫的原因 。
(4)D中干燥管中出现的现象及化学方程式 。
(5)有同学认为D中的现象并不能说明氯的氧化性大于氮,需要在C之前加装洗气装置,请画出其装置图 (并注明盛装试剂)。
(6)还有什么方法能证明氧化性Cl2>S,用一种相关事实说明 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,2 — 二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.18 g·cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验室中可以用下图所示装置制备1,2—二溴乙烷,其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水)。

填写下列空白:
(1)写出本题中制备1,2—二溴乙烷的两个化学反应方程式:
___________________________________________________________
___________________________________________________________。
(2)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞。请写出发生堵塞时瓶b中的现象:_________________________________。
(3)容器c中NaOH溶液的作用是:__________________________________。
(4)某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量比正常情况下超过许多,如果装置的气密性没有问题,试分析其可能的原因:_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三聚氰胺含氮量较高,但对人体有害。一些不法乳制品企业为了提高乳制品中蛋白质含量,向乳制品中添加三聚氰胺,使儿童患肾结石。下图所示的实验装置可用来测定三聚氰胺的分子式。
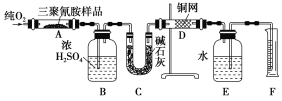
已知三聚氰胺的相对分子质量为126。取1.26 g三聚氰胺样品,放在纯氧中充分燃烧,生成CO2、H2O、N2,实验测得装置B增重0.54 g,C增重1.32 g,排入F中水的体积为672 mL(可按标准状况计算)。
(1)E装置的作用是________________________。
(2)需要加热的装置是____________(填字母)。
(3)装置D的作用是_________________________。
(4)F处读数时应该注意:_________________、__________________。
(5)三聚氰胺的分子式为___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求回答下列问题:
(1)下列物质:①HCl ②NaOH ③Cl2 ④H2O ⑤NH4Cl ⑥MgCl2 ⑦CaF2 ⑧CO2,其中只存在离子键的是:__(用序号回答,下同。);既存在离子键又存在共价键的是:__;试写出⑧的电子式:__;用电子式表示CaF2的形成过程___。
(2)在下列物质中,互为同素异形体的是__;互为同位素的是__。
①液氨和氨气 ②D2和T2 ③![]() K和
K和![]() Ca ④白磷和红磷 ⑤35Cl和37Cl ⑥O2和O3 ⑦12C和14C ⑧S2和S8
Ca ④白磷和红磷 ⑤35Cl和37Cl ⑥O2和O3 ⑦12C和14C ⑧S2和S8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室某浓硫酸试剂瓶标签上的有关数据,根据标签上的数据回答下列问题:

(1)取任意体积的该浓硫酸时,下列物理量会随所取体积的多少而发生变化的是________(选填相应字母编号)
A.溶液密度 B.溶液的物质的量浓度
C.溶液的质量分数 D.溶质的物质的量
(2)某学生欲用上述浓硫酸和蒸馏水配制450mL物质的量浓度为1.0mol·L-1的稀硫酸。
①该学生需要用量筒量取________mL上述浓硫酸进行配制。
②该实验中除了量筒、玻璃棒和烧杯外,还缺少的玻璃仪器有_________。
③在配制过程中,下列实验操作对所配制的稀硫酸的物质的量浓度有何影响?(在后面横线选择填写相应字母标号A、偏高;B、偏低;C、无影响)
I、用量筒量取浓硫酸时仰视凹液面读数_________
II、转移时容量瓶中已经有少量蒸馏水________
Ⅲ、定容时仰视刻度线__________
Ⅳ、定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水__________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com