
【题目】三聚氰胺含氮量较高,但对人体有害。一些不法乳制品企业为了提高乳制品中蛋白质含量,向乳制品中添加三聚氰胺,使儿童患肾结石。下图所示的实验装置可用来测定三聚氰胺的分子式。
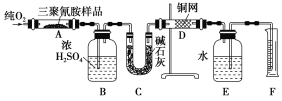
已知三聚氰胺的相对分子质量为126。取1.26 g三聚氰胺样品,放在纯氧中充分燃烧,生成CO2、H2O、N2,实验测得装置B增重0.54 g,C增重1.32 g,排入F中水的体积为672 mL(可按标准状况计算)。
(1)E装置的作用是________________________。
(2)需要加热的装置是____________(填字母)。
(3)装置D的作用是_________________________。
(4)F处读数时应该注意:_________________、__________________。
(5)三聚氰胺的分子式为___________________________________。
【答案】(1)用来排水,以测定氮气的体积 (2)AD (3)吸收未反应的氧气(4)量筒内的液面与广口瓶内的液面相平 视线与凹液面最低处相切 (5)C3N6H6
【解析】本实验的原理是通过测量三聚氰胺样品燃烧产生的CO2和H2O的质量以及生成的氮气的体积,从而确定各原子的物质的量之比,进而确定分子式。浓硫酸的作用是吸收产生的水蒸气,碱石灰的作用是吸收产生的CO2,因为O2也不溶于水,所以在用排水法收集N2之前应该用热的铜网将O2除净。测量N2的体积时,必须要保证集气瓶中的N2的压强和外界大气压相等。(5)三聚氰胺的物质的量为![]() =0.01 mol
=0.01 mol
n(H2O)=![]() =0.03 mol,n(H)=0.06 mol
=0.03 mol,n(H)=0.06 mol
n(CO2)=![]() =0.03 mol,n(C)=0.03 mol
=0.03 mol,n(C)=0.03 mol
n(N2)=![]() =0.03 mol,n(N)=0.06 mol
=0.03 mol,n(N)=0.06 mol
分子式为C3N6H6。


科目:高中化学 来源: 题型:
【题目】公元八世纪,Jabir ibn Hayyan在干馏硝石的过程中首次发现并制得硝酸(4KNO3![]() 2K2O+4NO↑+3O2↑),同时他也是硫酸和王水的发现者。下列说法正确的是
2K2O+4NO↑+3O2↑),同时他也是硫酸和王水的发现者。下列说法正确的是
A. 干馏产生的混合气体理论上可被水完全吸收
B. 王水是由3体积浓硝酸与1体积浓盐酸配制而成的
C. 王水溶解金时,其中的盐酸作氧化剂(Au+HNO3+4HCl=H[AuCl4]+NO↑+2H2O)
D. 实验室可用NaNO3与浓硫酸反应制备少量的HNO3,利用的是浓硫酸的氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶洞中溶有碳酸氢钙的水,当从洞顶向洞底滴落时,水分的蒸发、压强的减小及温度的升高都会析出碳酸钙沉淀。下列实验不能实现碳酸氢钙转化为碳酸钙的是( )
A.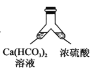 B.
B.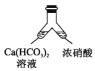 C.
C.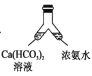 D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是某课外小组从初选后的方铅矿(主要成分PbS,含少量黄铜矿(CuFeS2))中提取硫磺、铜、铅的工艺流程:
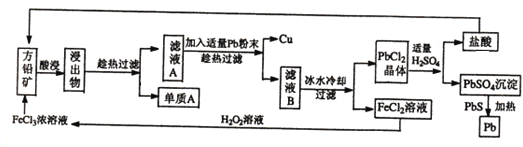
已知:CuFeS2+4FeCl3=2S+5FeCl2+CuCl2 、PbS+2FeCl3=S+PbCl2+2FeCl2
(1)黄铜矿( CuFeS2 )中Fe元素的化合价为 ______ ,提高方铅矿酸浸效率的措施有 ______ (写出两种方法即可)。
(2)过滤过程中用到的玻璃仪器有烧杯、玻璃棒、 ______ ;单质A是 ______ ,在此工艺操作中可循环利用的物质有铅和 ______ 。
(3)在酸性的FeCl2溶液中加入H2O2溶液,其反应的离子方程式为 ______ 。
(4)PbSO4与PbS加热条件下反应的化学方程式为 ______ 。
将沉淀PbSO4与足量的碳酸钠溶液混合,沉淀可转化可转化为PbCO3,写出该反应的平衡常数表达式:K= ______ 。(已知Ksp(PbSO4)=1.6×10-5,Ksp(PbCO3)=3.3×10-14)
(5)铅蓄电池的电极材料分别是Pb和PbO2,电解质溶液为硫酸;铅蓄电池充放电的总反应方程式为:PbO2+Pb+2H2SO4![]() 2PbSO4+2H2O,充电时,铅蓄电池阳极的电极反应式为 ______ 。
2PbSO4+2H2O,充电时,铅蓄电池阳极的电极反应式为 ______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】”生活无处不化学”.下列关于生活中的问题解释不合理的是
A.食盐不慎洒落在 天然气的火焰上,观察到黄色火焰,其原因:2Na+O2![]() Na2O2
Na2O2
B.沾水的铁制品器皿高温灼烧会发黑,其可能原因:3Fe+4H2O![]() Fe3O4+4H2
Fe3O4+4H2
C.Al(OH)3可用于中和过多的胃酸,其原因:Al(OH)3+3HCl=AlCl3+3H2O
D.明矾可以净水,是因为明矾[KAl(SO4)2·H2O]溶于水能生成Al(OH)3胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是某品牌饮用矿物质水标签的部分内容。下列说法正确的是

A. 标签上给出的离子的物理量是物质的量浓度
B. 任何饮用水中氯离子(Cl-)的浓度均在10~27.3 mg/L之间
C. 该品牌饮用矿物质水中c(Mg2+)的最大值为2×10-4 mol/L
D. 一瓶该品牌饮用矿物质水中SO42-的物质的量不超过1×10-5 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物是评价空气质量的控制标准之一,作为空气污染物的氮氧化物(NOx)常指NO和NO2。
(1)下列关于氮氧化物有关叙述不正确的是:_______(填序号)
①对人体及动物有毒害作用;②造成土壤污染;③一氧化氮可结合血红蛋白造成人体缺氧;④是形成酸雨、酸雾的主要原因之一; ⑤增高大气温度;⑥与碳氢化合物形成光化学烟雾;⑦参与臭氧层的破坏;⑧一氧化氮分子作为一种传递神经信息的 信使分子 ,在使血管扩张,免疫,增强记忆力
(2)用CH4催化还原NOx可在一定程度上消除氮氧化物的污染。
已知:CH4(g)+4NO(g) ![]() 2N2(g)+CO2(g)+2H2O(g)的ΔH=-1160kJ·mol-1
2N2(g)+CO2(g)+2H2O(g)的ΔH=-1160kJ·mol-1
2NO2(g)+N2(g) ![]() 4NO(g) ΔH=+293 kJ·mol-1
4NO(g) ΔH=+293 kJ·mol-1
则该条件下,CH4催化还原NO2消除污染的热化学方程式为_______________。
(3)T1℃时,在刚性反应器中以投料比为1:3的NO(g)与O2(g)反应,其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总压强p随时间t的变化如下表所示[t=∞时,NO(g)完全反应]。
t/min | 0 | 40 | 80 | 160 | 260 | 700 | ∞ |
p/kPa | 32.8 | 30.7 | 29.9 | 29.4 | 29.2 | 28.8 | 26.9 |
①NO(g)与O2(g)合成的反应速率v=4.2×10-2×p2(NO)×p(O2)(kPa·min-1),t=42 min时,测得体系中p(O2)=22.4 kPa,则此时的v=_________kPa·min-1(计算结果保留1位小数)。
②若降低反应温度至T2℃,则NO(g)与O2(g)完全反应后体系压强p∞(T2℃)_________(填“大于”“等于”或“小于”)26.9kPa,原因是___________________________________。
③T1℃时,反应N2O4(g) ![]() 2NO2(g)的平衡常数Kp=___kPa(Kp为以分压表示的平衡常数,是指平衡时体系中生成气体压强幂之积与反应物气体压强幂之积的比值。计算结果保留3位小数)。
2NO2(g)的平衡常数Kp=___kPa(Kp为以分压表示的平衡常数,是指平衡时体系中生成气体压强幂之积与反应物气体压强幂之积的比值。计算结果保留3位小数)。
(4)铈元素(Ce)是镧系金属中自然丰度最高的一种,常见有+3、+4两种价态。雾霾中含有大量的污染物NO,可以被含Ce4+的溶液吸收,生成NO2-、NO3-(两者物质的量之比为1:1)。可采用电解法将上述吸收液中的NO2-转化为无毒物质,同时再生Ce4+,其原理如图所示。

①Ce4+从电解槽的_____(填字母代号)口流出。
②写出阴极的电极反应式:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A.足量的Fe在Cl2中燃烧只生成FeCl3
B.铁的化学性质比较活泼,它能和水蒸气反应生成H2和Fe(OH)3
C.向一瓶未知的近无色溶液中加入KSCN再加入几滴氯水,溶液变红,溶液中一定含有FeCl2
D.向某溶液中加NaOH溶液得白色沉淀,且颜色逐渐变为红褐色,说明该溶液只含Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在200 mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入5molL-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示。
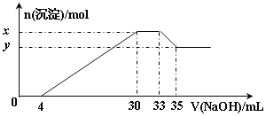
下列叙述不正确的是( )
A.原溶液中c(Cl-)=0.75 mol·L-1
B.x与y的差值为0.01 mol
C.原溶液的pH=1
D.原溶液中n(Mg2+):n(Al3+)=10:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com