
| 0.01mol?L-1 KIO3酸性溶液(含淀粉)的体积/mL | 0.01mol?L-1 Na2SO3溶液的体积/mL | H2O的体积 /mL | 实验 温度 /℃ | 溶液出现蓝色时所需时间/s | |
| 实验1 | 5 | V1 | 35 | 25 | |
| 实验2 | 5 | 5 | 40 | 25 | |
| 实验3 | 5 | 5 | V2 | 0 |
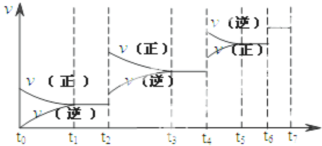


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、① | B、② | C、③ | D、④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
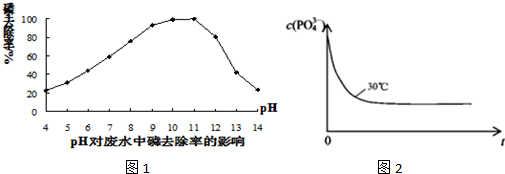
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、检验Cl-离子的试剂是硝酸银溶液和稀硝酸 |
| B、检验SO42-离子的试剂一般用氯化钡溶液和稀盐酸 |
| C、检验CO32-离子的试剂用盐酸和澄清石灰水 |
| D、在某溶液中加入BaCl2溶液产生白色沉淀,证明溶液中有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、工业上通过电解MgO制取镁 |
| B、工业上通过向浓缩的海水中通入氯气获得碘 |
| C、工业上主要通过高温冶炼黄铜矿获得铜 |
| D、工业上用二氧化锰与浓盐酸制备氯气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com