


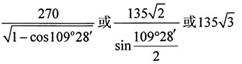



科目:高中化学 来源:不详 题型:单选题
| A.根据元素周期律,由HClO4可类推出氟元素也存在最高价氧化物的水化物HFO4 |
| B.在元素周期表的金属和非金属分界线附近寻找半导体材料 |
| C.元素周期表有7个周期,8个主族 |
| D.ⅠA族的元素全部是金属元素 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题



查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
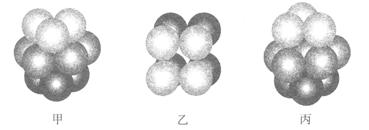
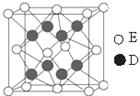
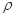 g·cm-3,阿伏加德罗常数为NA,
g·cm-3,阿伏加德罗常数为NA,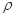 、NA的计算式表示)
、NA的计算式表示)查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CS2为V形的极性分子 | B.ClO3-的空间构型为平面三角形 |
| C.SF6中的空间构型为正四面体形 | D.SiF4和SO32-的中心原子均为sp3杂化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
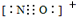

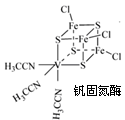
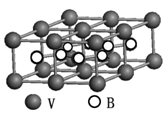
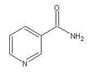
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |


查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| | CH4 | SiH4 | NH3 | PH3 |
| 沸点(K) | 101.7 | 161.2 | 239.7 | 185.4 |
| 分解温度(K) | 873 | 773 | 1 073 | 713.2 |
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.8 | 2.1 | 2.5 | 3.0 | 0.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com