



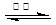 Ti+MgCl2 正四面体
Ti+MgCl2 正四面体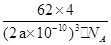
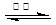 Ti+MgCl2 ;TiCl4的价层电子对数="4+1/2(4-4×1)=4," TiCl4分子中4个氯原子不在同一平面上,所以TiCl4的空间构型为正四面体型;
Ti+MgCl2 ;TiCl4的价层电子对数="4+1/2(4-4×1)=4," TiCl4分子中4个氯原子不在同一平面上,所以TiCl4的空间构型为正四面体型;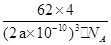 g.cm-3
g.cm-3

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:问答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ |  |  |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.碱性:KOH>NaOH>LiOH |
| B.酸性:HNO3>H3PO4>HClO4 |
| C.还原性:Cl->S2->I- |
| D.稳定性:H2O>HF>H2S |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
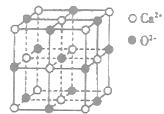
 ,下列有关说法正确的是________(填选项字母)。
,下列有关说法正确的是________(填选项字母)。| A.NaN3与KN3结构类似,前者晶格能较小 |
B.晶体钾的晶胞结构如右图所示,每个晶胞中分摊2个钾原子 |
| C.氮的第一电离能大于氧 |
| D.氮气常温下很稳定,是因为氮的电负性小 |
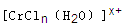 (n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:
(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应: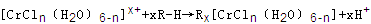
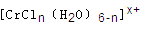 的溶液,与R-H完全交换后,中和生成的需浓度为
的溶液,与R-H完全交换后,中和生成的需浓度为查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 键的数目为____ __________________.
键的数目为____ __________________. g/cm
g/cm ,阿伏加德罗常数为
,阿伏加德罗常数为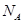 ,求晶胞边长a=________cm。(用含
,求晶胞边长a=________cm。(用含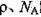 的计算式表示)
的计算式表示)
| A.第一电离能大小:S>P>Si |
| B.电负性顺序:C<N<O<F |
| C.因为晶格能Ca0比KCl高,所以KCl比CaO熔点低 |
| D.SO2与CO2的化学性质类似,分子结构也都呈直线型,相同条件下SO2的溶解度更大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| ①A、B、C、D、E、F为短周期主族元素,原子半径大小关系为A<D<C<B<F<E; |
| ②A与D形成的化合物常温下为液态; |
| ③B元素原子价电子(外围电子)排布为nSnnPn |
| ④F元素原子的核外p电子总数比s电子总数多1; |
| ⑤第一电子能:F<E; |
| ⑥G的基态原子核外有6个未成对电子; |
⑦H能形成红色(或砖红色)的 和黑色的HD两种化合物。 和黑色的HD两种化合物。 |
 中B原子采取的杂化轨道类型为 。
中B原子采取的杂化轨道类型为 。 分子的空间构型为 。
分子的空间构型为 。 极易溶于
极易溶于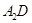 ,原因是 。
,原因是 。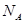 表示阿伏伽德罗常数,晶胞的边长为a。晶胞的高为h,则晶胞的密度可表示为 g/cm3。(用只含r和
表示阿伏伽德罗常数,晶胞的边长为a。晶胞的高为h,则晶胞的密度可表示为 g/cm3。(用只含r和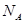 代数式表示)
代数式表示)
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题


查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 键有________mol。
键有________mol。

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 实验事实 | 理论解释 |
| A | 氮原子的第一电离能大于氧原子 | 氮原子2p能级半充满 |
| B | CO2为直线形分子 | CO2分子中C—O是极性键 |
| C | 金刚石的熔点低于石墨 | 金刚石是分子晶体,石墨是原子晶体 |
| D | HF的沸点高于HCl | HF的相对分子质量小于HCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com