
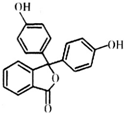
 酚酞医药名为果桃,可治疗消化系统疾病,其有效成分的结构简式如图所示.下列对该有效成分的说法正确的是( )
酚酞医药名为果桃,可治疗消化系统疾病,其有效成分的结构简式如图所示.下列对该有效成分的说法正确的是( )| A. | 所有原子可能共平面 | |
| B. | 能发生加聚反应生成高分子化合物 | |
| C. | 酚酞的水解产物中含有醇羟基 | |
| D. | 1 mol该物质最多能与含4 mol NaOH的烧碱溶液反应 |
分析 该分子中含有苯环、酚羟基、酯基,具有苯、酚和酯的性质,能发生加成反应、还原反应、氧化反应、水解反应、取代反应、中和反应等,据此分析解答.
解答 解:A.连接三个苯环的碳原子具有甲烷碳原子结构,为正四面体结构,所以所有原子不可能共面,故A错误;
B.不含碳碳双键,所以不能发生加聚反应,故B错误;
C.酯基水解后生成羧基和醇羟基,同时该水解产物还有酚羟基,故C正确;
D.酚羟基和酯基水解生成的羧基能和NaOH反应,1 mol该物质最多能与含3 mol NaOH的烧碱溶液反应,故D错误;
故选C.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,侧重考查烯酚、酯的性质,易错选项是C,注意酯基水解不产生酚羟基但该物质本身含有酚羟基,为易错点.


科目:高中化学 来源: 题型:填空题

| 容积 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| C(s) | H2O | H2 | ||||
| 甲 | 2 | T1 | 2 | 4 | 3.2 | 8 |
| 乙 | 1 | T2 | 1 | 2 | 1.2 | 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 3.0 L 0.1 mol•L-1 NaOH溶液中缓慢通入CO2至溶液增重8.8 g时,溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| B. | 常温下,将CH3COONa溶液和稀盐酸混合至溶液pH=7: c(Na+)>c(CH3COO-)>c(Cl-)=c(CH3COOH)>c(H+)=c(OH-) | |
| C. | 常温下,pH=3的醋酸溶液和pH=13的氢氧化钠溶液等体积混合后(不考虑混合后溶液体积的变化),恰好完全反应,则原醋酸溶液醋酸的电离度为1% | |
| D. | 物质的量浓度之比为1:2的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=2c(HCO3-)+2c(H2CO3)+2c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
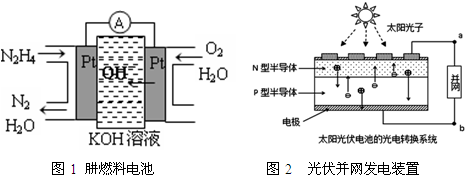
| A. | 氢氧燃料电池、太阳光伏电池中都利用了原电池原理 | |
| B. | 图1左边电极上发生的电极反应式为:N2H4-4e-+4OH-=N2+4H2O | |
| C. | 图2中N型半导体为正极,P型半导体为负极 | |
| D. | LED中的Ga和Y不可能都显+3价 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚乙烯食品包装袋、食物保鲜膜都是无毒的高分子材料 | |
| B. | 高温能杀死流感病毒是因为构成病毒的蛋白质受热变性 | |
| C. | 太阳能电池板中的硅是硅单质,光导纤维的主要成分是二氧化硅 | |
| D. | 明矾[KAl(SO4)2•12H2O]常用于自来水的净化、杀菌消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
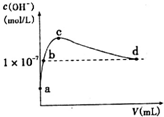 常温下,向l L pH=l0的NaOH溶液中持续通入CO2.通入CO2的体积(y)与溶液中水电离出的c(OH-)的关系如图所示.下列叙述错误的是( )
常温下,向l L pH=l0的NaOH溶液中持续通入CO2.通入CO2的体积(y)与溶液中水电离出的c(OH-)的关系如图所示.下列叙述错误的是( )| A. | a点溶液中:水电离出的c(H+)=1×10-10mol•L-1 | |
| B. | b点溶液中:c(H+)=1×10-7mol•L-1 | |
| C. | c点溶液中:c(Na+)>c(HCO3-)>c(CO32-) | |
| D. | d点溶液中:c(Na+)=2c(CO32-)+c(HCO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为防止食品氧化变质,食品袋中放有硅胶包 | |
| B. | 酒精用来杀菌消毒,利用了乙醇的氧化性 | |
| C. | 植物油与矿物油可以通过水解反应区分 | |
| D. | 明矾净水时发生了化学及物理变化,能起到杀菌、消毒的作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | La(NO3)3水溶液显酸性 | |
| B. | LaCl3的水溶液加热蒸发灼烧,最终得到无水LaCl3 | |
| C. | La和盐酸反应的离子方程式为:La+2H+=La3++H2↑ | |
| D. | 镧有两种核素:57139La和放射性57138La,由此可知镧元素的相对原子质量为138.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某校化学兴趣小组,通过下列装置探究Na2CO3和NaHCO3的热稳定性,设计如下的探究方案,请你参与并完成该探究方案.
某校化学兴趣小组,通过下列装置探究Na2CO3和NaHCO3的热稳定性,设计如下的探究方案,请你参与并完成该探究方案.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com