
 化学反应N2(g)+3H2(g)=2NH3(g)的能量变化如图所示,请回答下列问题:
化学反应N2(g)+3H2(g)=2NH3(g)的能量变化如图所示,请回答下列问题:分析 由能量变化图可知,反应物总能量大于生成物总能量,正反应为放热反应,反应热E2=C-A或E1-E3,以此解答该题.
解答 解:(1)图中A、C分别表示反应物总能量、生成物总能量,反应物总能量大于生成物总能量,正反应为放热反应,故答案为:反应物总能量;生成物总能量;放出;
(2)反应时,断裂N≡N键、H-H键,吸收能量,形成N-H键,放出能量,故答案为:N≡N键、H-H键;吸收;N-H键;放出;
(3)正反应为放热反应,反应热E2=C-A或E1-E3,故答案为:C-A;E1-E3.
点评 本题通过图象考查放热反应的能量变化,为高频考点,侧重于学生的分析能力的考查,注意物质的状态变化时的能量变化,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | ($\frac{3m}{2}$+$\frac{n}{2}$+2p)mol | B. | (3p-$\frac{3m}{2}$-$\frac{n}{2}$)mol | C. | 3pmol | D. | ($\frac{3m}{2}$+$\frac{n}{2}$)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
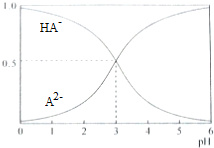 室温下,1mol/L的某二元酸H2A溶液中,可能存在的含A粒子(H2A,HA-,A2-)的物质的量分数(x)随pH变化的关系下图所示,下列说法正确的是( )
室温下,1mol/L的某二元酸H2A溶液中,可能存在的含A粒子(H2A,HA-,A2-)的物质的量分数(x)随pH变化的关系下图所示,下列说法正确的是( )| A. | H2A的电离方程式为H2A?H+HA- | |
| B. | 将pH=2的NaHA和Na2A混合溶液中加水稀释10倍,溶液的pH=3 | |
| C. | 将相同物质的量的NaHA和Na2A固体溶于水所得混合溶液的pH一定为3 | |
| D. | Na2A溶液存在:c(0H-)=c(H+)+c(HA-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 利用CH4和CO2可以制造价值更高的化学产品.已知下列反应:
利用CH4和CO2可以制造价值更高的化学产品.已知下列反应:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室需要0.1mol/L NaOH溶液900mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.
实验室需要0.1mol/L NaOH溶液900mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com