
【题目】【2016年高考新课标III卷】煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。回答下列问题:
(1)NaClO2的化学名称为_______。
(2)在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323 K,NaClO2溶液浓度为5×103mol·L1。反应一段时间后溶液中离子浓度的分析结果如下表。
离子 | SO42 | SO32 | NO3 | NO2 | Cl |
c/(mol·L1) | 8.35×104 | 6.87×106 | 1.5×104 | 1.2×105 | 3.4×103 |
①写出NaClO2溶液脱硝过程中主要反应的离子方程式__________。增加压强,NO的转化率______(填“提高”、“不变”或“降低”)。
②随着吸收反应的进行,吸收剂溶液的pH逐渐______ (填“增大”“不变”或“减小”)。
③由实验结果可知,脱硫反应速率______脱硝反应速率(填“大于”或“小于”)。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是___________。
(3)在不同温度下,NaClO2溶液脱硫、脱硝的反应中,SO2和NO的平衡分压pe如图所示。

①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均______________(填“增大”、“不变”或“减小”)。
②反应ClO2+2SO32===2SO42+Cl的平衡常数K表达式为___________。
(4)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。
①从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是_______。
②已知下列反应:
SO2(g)+2OH (aq) ===SO32 (aq)+H2O(l) ΔH1
ClO (aq)+SO32 (aq) ===SO42 (aq)+Cl (aq) ΔH2
CaSO4(s) ===Ca2+(aq)+SO42(aq)ΔH3
则反应
【答案】(1)亚氯酸钠;(2)①4OH-+3ClO2-+4NO=4NO3-+3Cl-+2H2O;提高②减小;
③大于;NO溶解度较低或脱硝反应活化能较高(3)①减小;②![]()
(4)①形成CaSO4沉淀,反应平衡向产物方向移动,SO2转化率提高②△H1+△H2-△H3
【解析】(1) NaClO2的化学名称为亚氯酸钠;
(2)①亚氯酸钠具有氧化性,则NaClO2溶液脱硝过程中主要反应的离子方程式为4OH-+3ClO2-+4NO=4NO3-+3Cl-+2H2O;正反应是体积减小的,则增加压强,NO的转化率提高。
②根据反应方程式2H2O+ClO2-+2SO2=2SO42-+Cl-+4H+、2H2O+3ClO2-+4NO=4NO3-+3Cl-+4H+可知随着吸收反应的进行氢离子浓度增大,吸收剂溶液的pH逐渐降低。
③由实验结果可知,在相同时间内硫酸根离子的浓度增加的多,因此脱硫反应速率大于脱硝反应速率。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是二氧化硫的还原性强,易被氧化。
(3)在不同温度下,NaClO2溶液脱硫、脱硝的反应中,SO2和NO的平衡分压pe如图所示。
①由图分析可知,反应温度升高,SO2和NO的平衡分压负对数减小,这说明反应向逆反应方向进行,因此脱硫、脱硝反应的平衡常数均减小。
②根据反应的方程式ClO2+2SO32===2SO42+Cl可知平衡常数K表达式为![]() 。
。
(4)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。
①①形成CaSO4沉淀,反应平衡向产物方向移动,SO2转化率提高,所以Ca(ClO)2效果好。
②已知:a.SO2(g)+2OH (aq) ===SO32 (aq)+H2O(l) ΔH1
b.ClO (aq)+SO32 (aq) ===SO42 (aq)+Cl (aq) ΔH2
c.CaSO4(s) ===Ca2+(aq)+SO42(aq)ΔH3
则根据盖斯定律可知a+b-c即得到反应SO2(g)+ Ca2+(aq)+ ClO (aq) +2OH (aq) === CaSO4(s) +H2O(l) +Cl (aq)的ΔH=△H1+△H2-△H3。


科目:高中化学 来源: 题型:
【题目】下列各反应中,生成物不随反应条件或反应物的用量变化而变化的是
A. 铁丝和氯气 B. NaOH和CO2 C. Fe和稀HNO3 D. Na和O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.升高温度或加入催化剂,可以改变化学反应的反应热
B.电解池是化学能转变成电能的装置
C.将碘酒滴在馒头上,可观察到馒头变蓝色
D.葡萄糖、淀粉、蛋白质均属于高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由乙烯推测丙烯的结构或性质正确的是 ( )
A.分子中三个碳原子在同一直线上 B.分子中所有原子都在同一平面上
C.与HCl加成只生成一种产物 D.能发生加聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列事实的解释正确的是
A. 氯气可以使湿润的有色布条褪色,是因为氯气具有漂白性
B. 分别用盛满HC1气体和盛满NO2气体的烧瓶做喷泉实验,喷泉结束后,所得溶液的物质的量浓度相同
C. 向50mL 18 mol/L的H2SO4溶液中加入足量的铜片加热充分反应后,被还原的H2SO4的物质的量等于0.45 mol
D. 常温下,浓硝酸可以用铝制容器贮存,说明铝与浓硝酸不反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来高铁酸钾(K2FeO4)己经被广泛应用在水处理方面,高铁酸钾的氧化性很强,是一种集氧化、吸附、凝聚、杀菌的新型高效的多功能水处理剂。高铁酸钾在水处理过程中涉及到的化学过程正确的有( )
①蛋白质的变性②蛋白质的盐析③胶体聚沉④盐类水解⑤焰色反应⑥氧化还原反应
A. ①②③④ B. ①③④⑥ C. ②③④⑤ D. ②③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列无色透明溶液中能大量共存的离子组是
A. Na+、Al3+、HCO3-、NO3-
B. OH-、Cl-、Mg2+、K+
C. NH4+、Na+、CH3COO-、NO3-
D. Na+、NO3-、Fe3+、I-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。
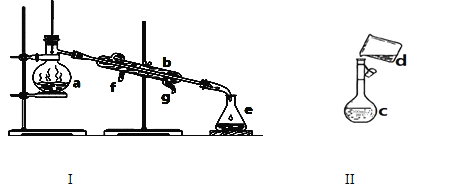
(1)写出下列仪器的名称:
a.________b._______ c._________。
(2)仪器a~e中,使用前必须检查是否漏水的有_________________。(填序号)
(3)现需配制0.1mol/LNaOH溶液450ml,装置II是某同学转移溶液的示意图。
①图中的错误是_______________。除了图中给出的仪器和托盘天平外,为完成实验还需要的仪器有:______
②根据计算得知,所需NaOH的质量为_______g。
③配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次)________________。
a.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
b.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
c.将溶解的氢氧化钠溶液沿玻璃棒注入500mL的容量瓶中
d.将容量瓶盖紧,振荡,摇匀
e.改用胶头滴管加水,使溶液凹面恰好与刻度相切
f.继续往容量瓶内小心加水,直到液面接近刻度2~3cm处
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com