
【题目】以下有关物质用途叙述错误的是
A.硫:制硫酸B.碳酸钡:钡餐,检查肠胃
C.液氮:冷冻物质D.明矾:净水剂
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
【题目】利用如图所示装置可制取 H2,两个电极均为惰性电极,c 为阴离子交换膜。下列叙述正确的是

A. a 为电源的正极
B. 工作时,OH向左室迁移
C. 右室电极反应为:C2H5OH+H2O4e=CH3COO+5H+
D. 生成 H2 和 CH3COONa 的物质的量之比为 2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图表示反应2SO2(g)+O2(g)![]() 2SO3(g) △H<0的正反应速率随时间的变化情况,试根据此曲线判断下列说法可能正确的是
2SO3(g) △H<0的正反应速率随时间的变化情况,试根据此曲线判断下列说法可能正确的是
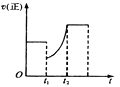
A. t1时增加了SO2和O2的浓度,平衡向正反应方向移动
B. t1时降低了温度,平衡向正反应方向移动
C. t1时减小了压强,平衡向逆反应方向移动
D. t1时减小了SO2的浓度,又增加了SO3的浓度,导致平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将固体NH4I置于密闭容器中,在一定温度下发生下列反应:
①NH4I(s)![]() NH3(g)+HI(g);②2HI(g)
NH3(g)+HI(g);②2HI(g)![]() H2(g)+I2(g)。
H2(g)+I2(g)。
达到平衡时,c(H2)=0.5mol·L-1,c(HI)=3mol·L-1,则此温度下反应①的平衡常数为
A. 9 mol2·L-2B. 12 mol2·L-2C. 16 mol2·L-2D. 20 mol2·L-2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,蜂胶已成为保健品的宠儿,其主要成分CAPE(咖啡酸苯乙酯)因具有极强的抗炎和抗氧化活性得以在食品、医学以及其他领域广泛应用。通过下列途径可合成咖啡酸苯乙酯。

已知:A的核磁共振氢谱(1HNMR)显示,分子中有4种不同化学环境的氢原子,A能与FeCl3溶液发生显色反应。
(1)丙二酸的结构简式为________________。
(2)咖啡酸苯乙酯含有的含氧官能团名称为_________________________。
(3)咖啡酸苯乙酯的分子式为________________,D的结构简式为____________________。
(4)反应类型:B―→C______________。
(5)A―→B的化学方程式为_______________________________________________________。
(6)写出同时满足下列条件的C的所有同分异构体的结构简式(不考虑立体异构):________________。
a.属于酯类
b.能发生银镜反应
c.与FeCl3溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计实验探究同主族碳、硅两元素的非金属性的强弱,根据要求完成下列问题:
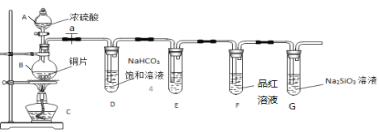
(1)填写所示仪器名称:A _______,B ______。
(2)铜与浓硫酸反应的化学方程式是____________________。
(3)装置E中足量酸性KMnO4溶液的作用是_________________。
(4)能说明碳元素的非金属性比硅元素非金属性强的实验现象是_________。
(5)依据试管D中实验现象,能否证明硫元素的非金属性强于碳元素的非金属性___(填“能”或“否”),试管D中发生反应的离子方程式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素 X、Y、Z、W 原子序数依次增大,X 是地壳中含量最多的元素,Y 原子的最外层只有一个电子,Z 位于元素周期表ⅢA族,W 与X属于同一主族。下列说法正确的是
A. 原子半径:r(W) > r(Z) > r(Y)
B. 由X、Y 组成的化合物中均不含共价键
C. Y 的最高价氧化物的水化物的碱性比Z的弱
D. X 的简单气态氢化物的热稳定性比W的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧是地球大气中一种微量气体,人类正在保护和利用臭氧。
(1)氮氧化物会破坏臭氧层,已知:
①NO(g) + O3(g)![]() NO2(g) + O2 (g) ΔH1 = 200.9 kJ·mol1
NO2(g) + O2 (g) ΔH1 = 200.9 kJ·mol1
②2NO(g) +O2 (g)![]() 2NO2 (g) ΔH 2 = 116.2 kJ·mol1
2NO2 (g) ΔH 2 = 116.2 kJ·mol1
则反应:2O3(g)![]() 3O2 (g) ΔH=______。
3O2 (g) ΔH=______。
(2)实验室将氧气和臭氧的混合气体0.896 L(标准状况)通入盛有20.0 g铜粉的反应器中,加热充分反应后,粉末的质量变为21.6 g。则原混合气中臭氧的体积分数为______。
(3)大气中的部分碘源于O3对海水中I—的氧化。将O3持续通入NaI溶液中进行模拟研究,探究Fe2+对氧化I—反应的影响,反应体系如图1,测定两组实验中I3—浓度实验的数据如图2所示:
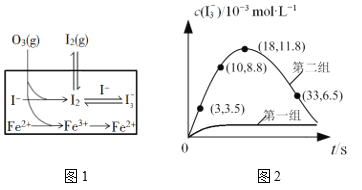
①反应后的溶液中存在化学平衡:I2(aq)+I(aq) ![]() I3-(aq),当c(I3-)/c(I-)=6.8时,溶液中c(I2)=______。(已知反应的平衡常数K=680)
I3-(aq),当c(I3-)/c(I-)=6.8时,溶液中c(I2)=______。(已知反应的平衡常数K=680)
②结合实验数据可知,Fe2+对I的转化率的影响是_____(填“增大”“无影响”或“减小”)。
③第二组实验18 s后,I3—浓度下降。导致I3—浓度下降的原因是_____。
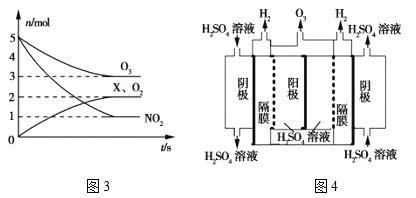
(4)臭氧是一种杀菌消毒剂,还是理想的烟气脱硝剂。
①一种脱硝反应中,各物质的物质的量随时间的变化如图3所示,X为___(填化学式)。
②一种臭氧发生装置原理如图4所示。阳极(惰性电极)的电极反应式为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com