
【题目】下图是教师在课堂中演示的两个实验装置(铁架台等辅助仪器略去)

请回答下列问题
(1)实验一的实验目的是 _____________________________________ , 实验过程中可以观察到烧杯中的现象是_______________________________________________________ ,加热后试管中发生反应的化学方程式是: ____________________________
(2)实验二用来验证Na2O2与CO2的反应,观察到的实验现象是:包有Na2O2的棉花燃烧。Na2O2与CO2的反应的化学方程式________________________________________ ,该实验可以得出许多结论,请你写出由该实验得出的两个结论。
结论1:__________________________________
结论2:__________________________________
【答案】比较Na2CO3和NaHCO3的热稳定性烧杯I中澄清石灰水不变浑浊,烧杯II中澄清石灰水变浑浊2NaHCO3![]() Na2CO3+H2O+CO2↑2Na2O2+2CO2=2Na2CO3+O2该反应放热该反应有氧气生成
Na2CO3+H2O+CO2↑2Na2O2+2CO2=2Na2CO3+O2该反应放热该反应有氧气生成
【解析】
(1)碳酸氢钠具有热不稳定,加热易分解,而碳酸钠稳定性较强,加热时难以分解,加热大试管时,碳酸钠的受热温度会高于碳酸氢钠,可根据是否产生气体判断稳定性强弱;碳酸氢钠加热分解放出二氧化碳,能够使澄清石灰水变浑浊,而碳酸钠比较稳定,对应的澄清石灰水不变浑浊,据此得出结论,写出反应的化学方程式;(2)包有Na2O2的棉花燃烧,则过氧化钠与二氧化碳的反应为放热反应,反应有氧气生成,以此来解答。
(1)碳酸氢钠具有热不稳定,加热易分解,而碳酸钠稳定性较强,加热时难以分解,加热大试管时,碳酸钠的受热温度会高于碳酸氢钠,故实验一的目的是比较Na2CO3和NaHCO3的热稳定性;碳酸氢钠具有热不稳定,加热分解生成二氧化碳气体,反应的化学方程式为:2NaHCO3![]() Na2CO3+H2O+CO2↑,二氧化碳可使澄清石灰水变浑浊,而碳酸钠难分解,则实验过程中可以观察到烧杯中的现象是烧杯I中澄清石灰水不变浑浊,烧杯II中澄清石灰水变浑浊;加热后试管中发生反应的化学方程式是: 2NaHCO3
Na2CO3+H2O+CO2↑,二氧化碳可使澄清石灰水变浑浊,而碳酸钠难分解,则实验过程中可以观察到烧杯中的现象是烧杯I中澄清石灰水不变浑浊,烧杯II中澄清石灰水变浑浊;加热后试管中发生反应的化学方程式是: 2NaHCO3![]() Na2CO3+H2O+CO2↑;
Na2CO3+H2O+CO2↑;
(1)实验二用来验证Na2O2与CO2的反应,观察到的实验现象是:包有Na2O2的棉花燃烧,即温度升高棉花燃烧,有氧气助燃,由此说明:该反应放热,该反应有氧气生成,反应的化学方程式为2Na2O2+2CO2═2Na2CO3+O2;根据上述分析可知,由该实验得出的结论有结论1: 该反应放热;结论2: 该反应有氧气生成。


科目:高中化学 来源: 题型:
【题目】茶是我国的传统饮品,茶叶中含有的茶多酚可以替代食品添加剂中对人体有害的合成抗氧化剂,用于多种食品保鲜等,如图所示是茶多酚中含量最高的一种儿茶素A的结构简式,关于这种儿茶素A的有关叙述正确的是

①等质量的儿茶素A分别与足量的金属钠和氢氧化钠反应,消耗金属钠和氢氧化钠的物质的量之比为1:1 ②分子式为C15H12O7③1mol儿茶素A与足量的浓溴水反应,最多消耗4molBr2④1mol儿茶素A在一定条件下最多能与7molH2加成.
A. ②④ B. ①④ C. ②③ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铁片与稀盐酸反应制取氢气时,下列措施不能使氢气生成速率增大的是( )
A.给该反应体系适当加热
B.向反应体系中加水稀释
C.向反应体系中加入适量浓盐酸
D.将铁片换成铁粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸为白色片状晶体,熔点122.4℃,苯甲酸是常用的食品防腐剂。苯甲酸在水中的溶解度为:
25℃ | 50℃ | 100℃ |
0.344g | 0.849g | 6.8g |
实验室有混有杂质(杂质为:泥沙和少量可溶性杂质)的粗苯甲酸,用下列实验方法(重结晶)可以分离得到纯净的苯甲酸晶体,实验步骤为:
A、将粗苯甲酸1g加到100mL的烧杯中,再加入50mL蒸馏水。
B、____________________________________,全溶后再加入少量蒸馏水。
C、使用短颈漏斗(下端玻璃管短的漏斗)趁热将溶液过滤到另一100mL烧杯中。
D、将滤液静置,使其缓慢冷却结晶,滤出晶体。
回答下列问题:
(1)上述步骤中有两次过滤操作,过滤用到的玻璃仪器有_________________________。步骤D中,需要洗涤晶体,洗涤步骤为:向过滤器中注入__________(填“冷水”或“热水”)至浸没沉淀,使洗涤液自然流下,重复操作2~3次。
(2)步骤B横线上的实验操作为_______________________________________________。
(3)步骤B中“全溶后再加入少量蒸馏水”和步骤C中“短颈漏斗”的作用是一样的,其目的是_____________________________________________________________。
(4)温度越低,苯甲酸的溶解度越小,但结晶时的温度并不是越低越好,请分析原因________。
(5)重结晶也适用于两种可溶性固体的分离,如NaCl和KNO3的分离。已知溶解度曲线如图:

KNO3固体中混有少量NaCl杂质,提纯KNO3的方法为:__________→__________,降温结晶→___________→洗涤。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某短周期非金属元素,其原子核外最外层电子数是次外层电子数的一半,该元素( )
A.在自然界中以化合态的形式存在
B.单质常用作半导体材料
C.最高价氧化物不与任何酸反应
D.气态氢化物比甲烷稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表前四周期A、B、C、D、E五种元素,A元素的原子最外层电子排布式为ms1;B元素的原子价电子排布式为ns2np2;C元素位于第二周期且原子中p能级与s能级电子总数相等;D元素原子的M能层的p能级中有3个未成对电子;E元素原子有五个未成对电子。
(1)写出E元素名称:________
(2)C基态原子的电子排布图为___________________,若A为非金属元素,则按原子轨道的重叠方式,A与C形成的化合物中的共价键属于________键(填“σ”或“π”)。
(3)当n=2时,BC分子的结构式是 ________;当n=3时,B与C形成的化合物与氢氧化钠溶液反应的离子方程式是______________。
(4)若A元素的原子最外层电子排布为2s1,B元素的原子价电子排布为3s23p2,A、B、C、D四种元素的第一电离能由大到小的顺序是__________________(用元素符号表示)。
(5)E元素原子的价电子排布式是________,在元素周期表中位置是______________,其最高价氧化物的化学式是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以氧化铝为原料,通过碳热还原法可合成氮化铝(AlN);通过电解法可制取铝。电解铝时阳极产生的CO2可通过二氧化碳甲烷化再利用。
请回答:
(1)已知:2Al2O3(s)===4Al(g)+3O2(g) ΔH1=3 351 kJ·mol-1
2C(s)+O2(g)===2CO(g) ΔH2=-221 kJ·mol-1
2Al(g)+N2(g)===2AlN(s) ΔH3=-318 kJ·mol-1
碳热还原Al2O3合成AlN的总热化学方程式是________________________,
该反应自发进行的条件________。
(2)在常压、Ru/TiO2催化下,CO2和H2混合气体(体积比1∶4,总物质的量a mol)进行反应,测得CO2转化率、CH4和CO选择性随温度变化情况分别如图1和图2所示(选择性:转化的CO2中生成CH4或CO的百分比)。
反应Ⅰ CO2(g)+4H2(g)![]() CH4(g)+2H2O(g) ΔH4
CH4(g)+2H2O(g) ΔH4
反应Ⅱ CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH5
CO(g)+H2O(g) ΔH5
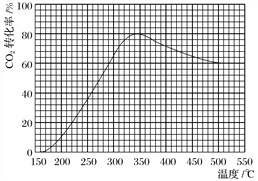
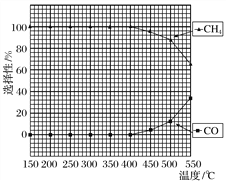
图1 图2
①下列说法不正确的是________。
A.ΔH4小于零
B.温度可影响产物的选择性
C.CO2平衡转化率随温度升高先增大后减少
D.其他条件不变,将CO2和H2的初始体积比改变为1∶3,可提高CO2平衡转化率
②350 ℃时,反应Ⅰ在t1时刻达到平衡,平衡时容器体积为V L,该温度下反应Ⅰ的平衡常数为________(用a、V表示)。
③350 ℃下CH4物质的量随时间的变化曲线如图3所示。画出400 ℃下0~t1时刻CH4物质的量随时间的变化曲线。__________________________
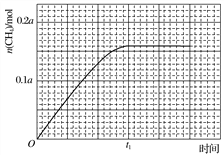
图3
(3)据文献报道,CO2可以在碱性水溶液中电解生成甲烷,生成甲烷的电极反应式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在水溶液中能够大量共存的是
A. H+、SO42-、SO32- B. Ba2+、CO32-、NO3-
C. Mg2+、Cl-、SO42- D. Ca2+、OH -、K+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com