
����Ŀ���л���A������ʯ�͵���Ҫ�л�����ԭ�ϣ������ʿ�����������һ������ʯ�ͻ�����չˮƽ��C��һ��������Ҳ������D��D��ʹʯ����Һ��죻E�Ǿ��й���ζ���л��F��һ�ָ߷��ӻ�������Ƴɶ��ְ�װ���ϣ� 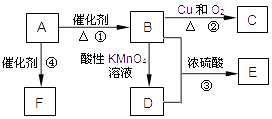
��1��A���ʵĽṹ��ʽΪ ��
��2��B��C�ķ�Ӧ���ͣ���
��3����Ӧ�۵Ļ�ѧ����ʽΪ ��
��4�������һ����ʵ�飬����֤C���ʴ��ڸù����ŵķ��� ��
���𰸡�
��1��CH2=CH2
��2��������Ӧ
��3��CH3COOH+CH3CH2OH ![]() CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
��4��ȡ����C���Թ��У�����������Һ��ˮԡ���ȣ�����������������������������ͭ��Һ��������ש����ɫ������������ȩ��
���������⣺A������ʯ�͵���Ҫ�л�����ԭ�ϣ������ʿ�����������һ������ʯ�ͻ�����չˮƽ������A��H2C=CH2 �� E�Ǿ��й���ζ���л��E��������ʹ���Ӧ����������B��Dһ������һ���Ǵ���B�ܱ���������D��A��Ӧ����B��̼ԭ�Ӹ������䣬����B��CH3CH2OH��D��CH3COOH��ͭ�����������������£�CH3CH2OH��������������C������C��CH3CHO���������Ҵ�����������Ӧ����EΪCH3COOCH2CH3 �� A��Ӧ����F��F��һ�ָ߾����ϩ�����Ӿ۷�Ӧ���ɸ߾���FΪ ![]() ����1��ͨ�����Ϸ���֪��AΪCH2=CH2 �� ���Դ��ǣ�CH2=CH2����2��B��������������C�����Է�Ӧ������������Ӧ�����Դ��ǣ�������Ӧ����3���÷�ӦΪ�Ҵ��������������Ӧ����Ӧ����ʽΪCH3COOH+CH3CH2OH
����1��ͨ�����Ϸ���֪��AΪCH2=CH2 �� ���Դ��ǣ�CH2=CH2����2��B��������������C�����Է�Ӧ������������Ӧ�����Դ��ǣ�������Ӧ����3���÷�ӦΪ�Ҵ��������������Ӧ����Ӧ����ʽΪCH3COOH+CH3CH2OH ![]() CH3COOCH2CH3+H2O�����Դ��ǣ�CH3COOH+CH3CH2OH
CH3COOCH2CH3+H2O�����Դ��ǣ�CH3COOH+CH3CH2OH ![]() CH3COOCH2CH3+H2O����4��CΪ��ȩ��������������Ӧ������������ͭ����Һ������ȩ��ȩ��������鷽��Ϊȡ����C���Թ��У�����������Һ��ˮԡ���ȣ�����������������������������ͭ��Һ��������ש����ɫ������������ȩ����
CH3COOCH2CH3+H2O����4��CΪ��ȩ��������������Ӧ������������ͭ����Һ������ȩ��ȩ��������鷽��Ϊȡ����C���Թ��У�����������Һ��ˮԡ���ȣ�����������������������������ͭ��Һ��������ש����ɫ������������ȩ����
���Դ��ǣ�ȡ����C���Թ��У�����������Һ��ˮԡ���ȣ�����������������������������ͭ��Һ��������ש����ɫ������������ȩ����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ӡ�ʵ���У�3I��+S2O ![]() �TI
�TI ![]() +2SO
+2SO ![]() �ķ�Ӧ���ʿ�����I
�ķ�Ӧ���ʿ�����I ![]() �����ĵ�����Һ����ɫ��ʱ��t��������tԽС����Ӧ����Խ��ij̽����ѧϰС����20�����ʵ�飬�õ����������±���
�����ĵ�����Һ����ɫ��ʱ��t��������tԽС����Ӧ����Խ��ij̽����ѧϰС����20�����ʵ�飬�õ����������±���
ʵ���� | �� | �� | �� | �� | �� |
c��I����/mol/L | 0.040 | 0.080 | 0.080 | 0.160 | 0.120 |
c��S2O | 0.040 | 0.040 | 0.080 | 0.020 | 0.040 |
t/s | 88.0 | 44.0 | 22.0 | 44.0 | t1 |
�ش��������⣺
��1����ʵ���Ŀ���ǣ� ��
��2�����ݢ١��ڡ�������ʵ������ݣ��Ʋ���ɫʱ��t1= ��
��3���¶ȶԸ÷�Ӧ�ķ�Ӧ���ʵ�Ӱ�����һ����ɣ�����40���½��б�Ţ۶�ӦŨ�ȵ�ʵ�飬��ɫʱ��t2�ķ�ΧΪ ������ĸ����
A.��22.0s
B.22.0��44.0s
C.��44.0s
D.���ݲ��㣬���ж�
��4��ͨ�������Ƚ��ϱ����ݣ��õ��Ľ��� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȼ�ϵ�ʹ�úͷ���Ⱦ����ᷢչ��һ�����رܵ�ì�ܻ��⣮
��1���ҹ�����������ú��ů�������ķ�������������Ҫ��Դ֮һ�����о����ֽ�ú̿��O2/CO2��������ȼ�գ��ܹ�����ȼúʱNO���ŷţ���Ҫ��ӦΪ��
2NO��g��+2CO��g���TN2��g��+2CO2��g����H
����N2��g��+O2��g���T2NO��g����H1=+180.5kJmol��1
��2CO��g���T2C��s��+O2��g����H2=+221kJmol��1
��C��s��+O2��g���TCO2��g����H3=��393.5kJmol��1
���H=kJmol��1 ��
��2��Ϊ�����ȼ�ϵ������ʣ����Խ��״����Ϊȼ�ϵ�أ�д������K2CO3�������ʱ���״�ȼ�ϵ�صĸ�����Ӧʽ�����õ�ظ�����ˮ�����բ����ʱ�����Ա�����բ������ʴ�����ַ������� ��
��3�����м״��ķ�ˮ�����ŷŻ����ˮ��Ⱦ������ClO2��������ΪCO2 �� Ȼ���ټӼ��кͼ��ɣ�д�������״����Է�ˮ�����У�ClO2��״���Ӧ�����ӷ���ʽ�� ��
��4����������β��Ҳ�������γɵ�ԭ��֮һ�� 
�ٽ�������������ڴ��������£����������лӷ�������C3H6����ԭβ���е�NO����������������Ⱦ�����ʣ���д���ù��̵Ļ�ѧ����ʽ����
�ڵ绯ѧ�������������Dzⶨ����β�����õķ���֮һ������CO�������Ĺ���ԭ������ͼ��ʾ����Ե缫�ĵ缫��ӦʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ���� ( )
A.1 mol H2O������Ϊ18g/mol
B.CH4��Ħ������Ϊ16g
C.3.01��1023��SO2���ӵ�����Ϊ32g
D.��״����,1 mol�κ����������Ϊ22.4L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ԫ�صĵ��ʼ��仯����������������Ӧ�ü���㷺�������������գ� 
��1����������̽��
�����ͼʵ��װ�����Ʊ�����֤���������ʣ����ּг�װ��δ��������
��i��A�з��ù���������̵�װ�������� ��
��ii��װ��B�������� ��
��iii��Ӳ�ʲ�����C������װ������մ������Լ���������������ʵ������Ϊ ��
��iv��D�е�NaOH��Һ��������β������Ӧ���D�м�������ϡ�����������壬д���÷�Ӧ�����ӷ���ʽ ��
��2���Ʊ�HClO
���װ��E������ͼ��װ��C�������Ʊ��ϸ�Ũ�ȵ�HClO��Һ����Բ����ƿ�ײ�����һ����������ס�Ĺ�����״̼��ƣ�
�ٸ÷��������Ƶýϸ�Ũ��HClO��ԭ���ǣ���ϱ�Ҫ�Ļ�ѧ���Իش� ��
�ڷ�Ӧ��������������ʣ���ʯ��ʯ���Һ�棬���õ���Һ��ϡ�����ϣ�������������CO2���壬��Ӧ������Һ�е����ʳ�HClO�⣬����������д���ָ��εĻ�ѧʽ��һ�����Σ�һ����ʽ�Σ�����С��ͬѧ��÷�Ӧ��̼�����������M g����Ӧ������õ�200mL��Һ��ȡ��10mL������ϡ�����ϣ�����Fװ�ò�ò������������ΪV L���ѻ���ɱ�״��������ԭ��Һ�к������ε�Ũ��ΪmolL��1���ú�M��V�Ĵ���ʽ��ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڻ�ѧ��Ӧ������������˵������ȷ����
A. ��ѧ��Ӧ���������仯B. �������ʵ������ת��
C. �������ᷴӦΪ���ȷ�ӦD. �������͵ķ�ӦΪ���ȷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ش��������⣺
��1������ȥ�������������������̼�ظ֣�������Ũ�����У�10���Ӻ���������ͭ��Һ�У�Ƭ�̺�ȡ���۲죬�������������Ա仯����ԭ���� ��
��2������ȡ��ȥ�������������������̼�ظ֣�6.0g����15.0mLŨ�����У����ȣ���ַ�Ӧ��õ���ҺX���ռ�������Y��
�ټ�ͬѧ��ΪX�г�Fe3+����ܺ���Fe2+ �� д������Fe2+���п��ܵ����ӷ���ʽ�� �� ��д��һ�����ɣ�
����ͬѧȡ336mL����״��������Yͨ��������ˮ�У�������Ӧ�Ļ�ѧ����ʽΪ�� ��
Ȼ���������BaCl2��Һ�����ʵ�������ø������2.33g�����ڴ���֪����Y��SO2���������Ϊ ��
��3����100mLˮ��Ͷ��Na��Al��16�ˣ���ַ�Ӧ��ʣ�����1g������ų�H2�����Ϊ������״���£�
��4����һ������Fe��Fe2O3��CuO�����Ͷ��100mL 2.2mol/L��������Һ�У���ַ�Ӧ������896mL��״���µ����壬�ò�����1.28g�����˺�����Һ�м���2mol/L��NaOH��Һ������40mLʱ��ʼ���ֳ���������Һ��FeSO4�����ʵ���Ũ��Ϊ������Һ���Ϊ100mL��mol/L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
��1����һ���¶Ⱥ�ѹǿ�£�1���X2��g����3���Y2��g����������2���Z��g������Z����Ļ�ѧʽ����
��2��A��B����������ɵĻ������8.6 g���ڱ�״�������Ϊ8.96 L����֪A��B�����ʵ���֮��Ϊ3��1����Է�������֮��Ϊ14��1���ɴ˿��ƶ�A������ �� B��������
��3���ڱ�״���£�CO��CO2�Ļ����������Ϊ36 g�����Ϊ22.4 L����CO��ռ�������L�������� g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б�����ȷ����
A.�ø�����Ƶ�ԭ����ͨ�����������е��Ҵ��������
B.��������AB2������״̬���ܵ��磬˵��AB2�ǵ����
C.�ƹ�ʹ��úҺ���������Լ����������������̼���ŷ�
D.������������ࡢ��֬�������ʾ������Ⱦ���ˮ����ܱ�����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com