
【题目】下面是几种实验中常用的仪器
A![]() B
B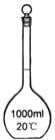 C
C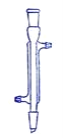 D
D![]()
(1)写出下列代号所代表的仪器的名称:C___________;D___________
(2)分离水和四氯化碳可选用的仪器________ (填仪器代号)。
(3)操作时怎样才能使C仪器中装满所需的水?____________ 。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是中学常见的五种化合物,它们之间有下列转化关系:
![]()
已知A溶液显碱性,焰色反应为黄色,且可促进水的电离。
(1)若A、B、C中含有相同的金属元素,且B为白色沉淀物,则A的化学式为____,D的化学式为_____;A、C反应生成B的离子方程式为___________。
(2)若C是一种无色无味的气体,用离子方程式表示A溶液显碱性的原因___________,C与E反应生成B的化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某制碱制得的纯碱中含有NaHCO3和NaCl杂质。某实验小组对此碱样品进行检查。
(1)取此碱样品10g,加热到质量不再减少,冷却称重,称得质量为9.845g,该样品中NaHCO3的质量分数为__________________________。
(2)另取10g固体样品,加蒸馏水溶解,配成250mL一定物质的量浓度的溶液,配制过程中必需使用的化学仪器有______________________(填字母)
A.烧杯 B.250mL容量瓶C.漏斗 D.胶头滴管 E.玻璃棒 F.试管
(3)量取上述配制好的溶液25mL,向其中加入过量盐酸至 不再产生气泡,共收集到190.4mL(标准状况)气体,该反应过程的离子方程式为______________________、_______________________。10g该样品中含____________gNaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pAg=-lgc(Ag+),Ksp(AgCl)=1×10-12,Ksp (AgI)=1×10-16。如图是向10mLAgNO3溶液中逐滴滴入0.1mo1·L-1的NaCl溶液时,pAg随着加入NaCl溶液的体积变化的图像(实线)。下列叙述正确的是
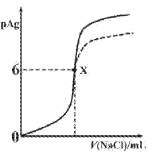
A. 原AgNO3溶液的物质的量浓度为0.1mol·L-1
B. 图中x点表示溶液中Ag+恰好完全沉淀
C. 图中x点的坐标为(10,6)
D. 若把NaCl溶液换成0.1mol·L-1NaI溶液,则图像在终点后变为虚线部分
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①盐酸、②铁、③碳酸氢钠、④二氧化硅是常见的物质。请回答下列问题。
(1)上述4种物质中属于盐的是______ (填序号,下同);水溶液能使紫色石蕊溶液变红的是______ 。
(2)写出盐酸的电离方程式___________。
(3)写出二氧化硅与氢氧化钠溶液反应的化学方程式_____________。
(4)碳酸氢钠可治疗胃酸(0.2%~0.4%的盐酸)过多,反应的离子方程式为_______。等物质的量的碳酸钠和碳酸氢钠与足量盐酸反应时生成CO2的量,前者_______后者(填“>”、“<”或“=”)。
(5)氯碱工业是以电解饱和食盐水为基础的基本化学工业。电解饱和食盐水的产物中一种是所有气体中密度最小的气体、一种是黄绿色气体和一种易溶、易电离的碱,则电解食盐水的化学方程式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是

A.电极B上发生的电极反应为:O2+2CO2+4e-=2CO32-
B.电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O
C.电池工作时,CO32-向电极B移动
D.反应CH4+H2O![]() 3H2+CO,每消耗1molCH4转移12mol
3H2+CO,每消耗1molCH4转移12mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,Ka (HCOOH)=1.77×10-4,Ka (CH3COOH)=1.75×10-5,Kb (NH3·H2O) =1.76×10-5,下列说法正确的是( )
A. 将CH3COONa溶液从20℃升温至30℃,溶液中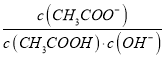 增大
增大
B. 用相同浓度的NaOH溶液分别滴定等体积pH均为3的HCOOH和CH3COOH溶液至终点,消耗NaOH溶液的体积相等
C. 0.2 mol/L HCOOH 与 0.1 mol/L NaOH 等体积混合后:c(HCOO-) + c(OH-) = c(HCOOH) + c(H+)
D. 0.2 mol/L CH3COONa 与 0.1 mol/L盐酸等体积混合后 (pH<7):c(CH3COO-) > c(Cl- ) >c(CH3COOH) >c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂用提取粗盐后的盐卤(主要成分为MgCl2)制备金属镁,其工艺流程如图。
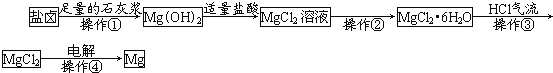
下列说法正确的是( )
A.操作①发生的反应为氧化还原反应
B.若在实验室进行操作①只需要漏斗和烧杯两种玻璃仪器
C.操作②是蒸发浓缩、冷却结晶
D.在整个制备过程中,发生复分解反应、氧化还原反应、分解反应、置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2SO3是一种白色粉末,工业上可用作还原剂、防腐剂等。某化学小组探究不同pH的Na2SO3溶液与同浓度AgNO3溶液反应的产物,进行如下实验。
实验Ⅰ 配制500 mL 一定浓度的Na2SO3溶液
①溶解:准确称取一定质量的Na2SO3晶体,用煮沸的蒸馏水溶解。蒸馏水需煮沸的原因是____
②移液:将上述溶解后的Na2SO3溶液在烧杯中冷却后转入仪器A中,则仪器A为 __,同时洗涤____(填仪器名称)2~3次,将洗涤液一并转入仪器A中;
③定容:加水至刻度线1~2 cm处,改用胶头滴管滴加蒸馏水至液面与刻度线相切,盖好瓶塞,反复上下颠倒,摇匀。
实验Ⅱ 探究不同pH的Na2SO3溶液与pH=4的AgNO3溶液反应的产物
查阅资料:i.Ag2SO3为白色固体,不溶于水,溶于过量Na2SO3溶液
ii.Ag2O,棕黑色固体,不溶于水,可与浓氨水反应
(1)将pH=8的Na2SO3溶液滴人pH=4的AgNO3溶液中,至产生白色沉淀。
假设一:该白色沉淀为Ag2SO3
假设二:该白色沉淀为Ag2SO4
假设三:该白色沉淀为Ag2SO3和Ag2SO4的混合物
①写出假设一的离子方程式 ____;
②提出假设二的可能依据是_____;
③验证假设三是否成立的实验操作是____。
(2)将pH=4的AgNO3溶液逐滴滴人足量的pH=11的Na2SO3溶液中,开始产生白色沉淀A,然后变成棕黑色物质。为了研究白色固体A的成分,取棕黑色固体进行如下实验:
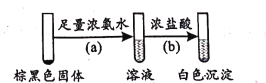
①已知反应(b)的化学方程式为Ag(NH3)2OH+3HCl=AgCl↓+2NH4Cl+H2O,则反应(a)的化学方程式为____;
②生成白色沉淀A的反应为非氧化还原反应,则A的主要成分是____(写化学式)。
(3)由上述实验可知,盐溶液间的反应存在多样性。经验证,(1)中实验假设一成立,则(2)中实验的产物不同于(1)实验的条件是 ___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com