
【题目】①盐酸、②铁、③碳酸氢钠、④二氧化硅是常见的物质。请回答下列问题。
(1)上述4种物质中属于盐的是______ (填序号,下同);水溶液能使紫色石蕊溶液变红的是______ 。
(2)写出盐酸的电离方程式___________。
(3)写出二氧化硅与氢氧化钠溶液反应的化学方程式_____________。
(4)碳酸氢钠可治疗胃酸(0.2%~0.4%的盐酸)过多,反应的离子方程式为_______。等物质的量的碳酸钠和碳酸氢钠与足量盐酸反应时生成CO2的量,前者_______后者(填“>”、“<”或“=”)。
(5)氯碱工业是以电解饱和食盐水为基础的基本化学工业。电解饱和食盐水的产物中一种是所有气体中密度最小的气体、一种是黄绿色气体和一种易溶、易电离的碱,则电解食盐水的化学方程式:___________。
【答案】③ ① HCl=H++Cl- SiO2+2NaOH=Na2SiO3+H2O HCO3-+H+=H2O+CO2↑ = 2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
【解析】
(1)由金属阳离子(或铵根离子)和酸根离子组成的化合物属于盐;酸使紫色石蕊溶液变红;
(2)盐酸是强酸,完全电离产生氢离子和氯离子;
(3)二氧化硅与氢氧化钠反应生成硅酸钠和水,据此写出反应的方程式;
(4)碳酸氢钠与盐酸反应生成氯化钠、水和二氧化碳,根据离子方程式的书写方法书写;二者都可与盐酸反应生成二氧化碳气体,结合方程式判断;
(5)根据电解饱和食盐水的电解原理,阴极产生氢气和氢氧化钠,阳极产生氯气,写出电解饱和食盐水的电解方程式。
(1)①盐酸属于酸、能使紫色石蕊溶液变红②铁是单质③碳酸氢钠是盐④二氧化硅是氧化物;故答案为:③;①;
(2)盐酸是强酸,完全电离产生氢离子和氯离子,方程式为:HCl=H++Cl-,故答案为:HCl=H++Cl-;
(3)二氧化硅与氢氧化钠溶液反应生成了硅酸钠和水,反应的离子方程式为:SiO2+2NaOH=Na2SiO3+H2O,故答案为:SiO2+2NaOH=Na2SiO3+H2O;
(4)碳酸氢钠与盐酸反应生成氯化钠、水和二氧化碳,反应的离子方程式为:HCO3-+H+=H2O+CO2↑;碳酸氢钠与足量盐酸反应的化学方程式为:NaHCO3+ HCl= NaCl+ H2O+CO2↑,碳酸钠与足量盐酸反应的化学方程式为:Na2CO3+2HCl=2NaCl+H2O+CO2↑,由以上两个化学方程式可以看出,等物质的量的Na2CO3和NaHCO3分别与HCl反应,产生CO2的物质的量之比为:1: 1;故答案为:HCO3-+H+=H2O+CO2↑;=;
(5)通电后阴极氢离子放电,阴极产生氢气和氢氧化钠,阳极上氯离子放电产生氯气,电解反应方程式: 2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑;故答案为:2NaCl+2H2O
2NaOH+H2↑+Cl2↑;故答案为:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑。
2NaOH+H2↑+Cl2↑。


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
【题目】由丙烯经下列反应可得到F、G两种高分子化合物,它们都是常用的塑料。
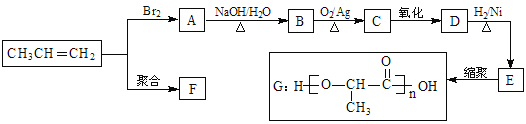
(1)D中官能团名称______________________。
(2)丙烯转化为A的反应类型为___________,A转化为B的反应类型为___________。
(3)E的化学名称为______________________。
(4)丙烯聚合为F的化学方程式是_________________________________
(5)写出C与银氨溶液反应的化学方程式________________________________________。
(6)E有多种同分异构体,其中一种能发生银镜反应,且核磁共振氢谱有五组峰,则该种同分异构体的结构简式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)在室温下,等体积、等浓度的氢氧化钠与醋酸混合后溶液呈__性,溶液中c(Na+)__c(CH3COO-)(填“>”“=”或“<”);pH=13的氢氧化钠与pH=1的醋酸等体积混合后溶液呈__性,溶液中c(Na+)___c(CH3COO-)(填“>”“=”或“<”);
(2)下列溶液,①0.1mol/L HCl溶液②0.1mol/L H2SO4溶液③0.1mol/L NaOH溶液④0.1mol/L CH3COOH溶液,按pH由小到大顺序为___。
(3)CuSO4的水溶液呈酸性的原因是(用离子方程式表示):____;实验室在配制CuSO4的溶液时,常将CuSO4固体先溶于较浓的硫酸中,然后再用蒸馏水稀释到所需的浓度,以___(填“促进”、“抑制”)其水解。
(4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,充分反应后溶液呈中性,则反应后溶液存在的离子有____,其浓度由大到小的顺序为_____,氨水的浓度a__0.01 mol·L-1(填“>”、“ <”或“=”)。
(5)已知:难溶电解质Cu(OH)2在常温下的KSP=2×10-20,则常温下:某CuSO4溶液中c(Cu2+)=0.02molL-1,如要生成Cu(OH)2沉淀,应调整溶液的pH最小为____。
(6)某工厂的电镀污泥中含有铜、铁等金属化合物。为实现资源的回收利用并有效防止环境污染,设计如下工艺流程:


①酸浸后加入H2O2的目的是_____________,调pH的最适宜范围为_______。
②调pH过程中加入的试剂最好是_________。
A.NaOH B.CuO C.NH3·H2O D.Cu2(OH)2CO3
③煮沸CuSO4溶液的原因是_____;向CuSO4溶液中加入一定量的NaCl、Na2SO3,可以生成白色的CuCl沉淀,反应的化学方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国“神舟七号”载人飞船的火箭燃料主要是偏二甲肼(用R表示)和四氧化二氮,在火箭发射时,两者剧烈反应产生大量气体并释放出大量的热,该反应的化学方程式为:R+2N2O4═3N2+4H2O+2CO2,下列叙述错误的是
A.此反应是氧化还原反应
B.R的分子式为C2H8N2
C.在反应中N2O4做还原剂
D.生成3mol N2时电子转移数为16mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合题图10 的是
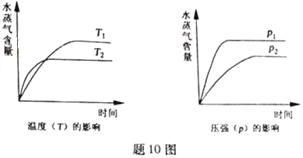
A. CO2(g)+2NH3(g)![]() CO(NH2)2(s)+H2O(g);△H<0
CO(NH2)2(s)+H2O(g);△H<0
B. CO2(g)+H2(g)![]() CO(g)+H2O(g);△H>0
CO(g)+H2O(g);△H>0
C. CH3CH2OH (g)![]() CH2=CH2(g)+H2O(g);△H>0
CH2=CH2(g)+H2O(g);△H>0
D. 2C6H5CH2CH3(g)+O2(g)![]() 2 C6H5CH=CH2(g)+2H2O(g);△H<0
2 C6H5CH=CH2(g)+2H2O(g);△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是几种实验中常用的仪器
A![]() B
B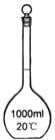 C
C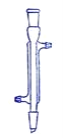 D
D![]()
(1)写出下列代号所代表的仪器的名称:C___________;D___________
(2)分离水和四氯化碳可选用的仪器________ (填仪器代号)。
(3)操作时怎样才能使C仪器中装满所需的水?____________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 甲苯与足量H2加成产物的一氯取代物有5种
B. ![]() 由3种单体加聚得到
由3种单体加聚得到
C. 双糖、多糖在稀酸的催化下最终均水解为葡萄糖
D. 分子式为C4H6O2并能与饱和NaHCO3溶液反应生成CO2的有机物有3种(不含立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,工业上从海水中提取食盐和溴的过程如图:

操作Ⅱ发生反应的离子方程式为___;如果用碳酸钠溶液代替操作Ⅱ中的二氧化硫水溶液,则生成物中溴的化合价分别为+5和﹣1价,且操作Ⅲ中用稀硫酸代替氯气,请写出这种情况下操作Ⅲ中发生反应的离子方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验事实:
(1)X+Y2+=X2++Y;(2)Z+2H2O![]() Z(OH)2+H2↑;(3)Z2+离子的放电能力比X2+弱;(4)由Y、W 作电极组成的原电池反应为:Y-2e-=Y2+,由此可知,X、Y、Z、W的还原性由强到弱的顺序是
Z(OH)2+H2↑;(3)Z2+离子的放电能力比X2+弱;(4)由Y、W 作电极组成的原电池反应为:Y-2e-=Y2+,由此可知,X、Y、Z、W的还原性由强到弱的顺序是
A. X > Y > Z > WB. Y > X > W > Z
C. Z > X > Y > WD. Z > Y > X > W
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com