
【题目】海水是巨大的资源宝库,工业上从海水中提取食盐和溴的过程如图:

操作Ⅱ发生反应的离子方程式为___;如果用碳酸钠溶液代替操作Ⅱ中的二氧化硫水溶液,则生成物中溴的化合价分别为+5和﹣1价,且操作Ⅲ中用稀硫酸代替氯气,请写出这种情况下操作Ⅲ中发生反应的离子方程式:___。
【答案】SO2+Br2+2H2O=SO42-+2Br-+4H+ BrO3-+5Br-+6H+=3Br2+3H2O
【解析】
海水淡化得到氯化钠,电解氯化钠溶液或熔融状态氯化钠会生成氯气,氯气通入母液中发生反应得到低浓度的溴单质溶液,通入热空气吹出后用二氧化硫水溶液吸收得到含HBr的溶液,通入适量氯气氧化得到溴单质,富集溴元素,蒸馏得到工业溴,
步骤Ⅱ用SO2水溶液吸收Br2,使溴蒸气转化为氢溴酸以达到富集的目的;生成物中溴的化合价分别为+5和-1价,在酸性条件下可发生归中反应生成溴,根据电子得失守恒配平;
操作Ⅱ是二氧化硫吸收溴单质发生反应生成硫酸和溴化氢,使溴蒸气转化为氢溴酸以达到富集的目的.其反应离子方程式为:SO2+Br2+2H2O═SO42﹣+2Br﹣+4H+,用碳酸钠溶液代替操作Ⅱ中的二氧化硫水溶液,生成物中溴的化合价分别为+5和﹣1价,操作Ⅲ中发生的反应是在酸性条件下归中反应生成溴,反应的方程式为:BrO3﹣+5Br﹣+6H+=3Br2+3H2O,故答案为:SO2+Br2+2H2O═SO42﹣+2Br﹣+4H+;BrO3﹣+5Br﹣+6H+=3Br2+3H2O;


科目:高中化学 来源: 题型:
【题目】如图为实验室制取和收集纯净干燥的氯气,并进行氯气性质探究的实验装置图:
(1)反应前,在__中装浓盐酸(填写仪器名称),__中装MnO2(填写仪器名称)。
(2)装置A中所装试剂是__,目的__。装置B中所装的试剂是___,目的__。
(3)装置D中所装试剂是__,发生反应的化学方程式为__。
(4)实验室制取Cl2的化学方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①盐酸、②铁、③碳酸氢钠、④二氧化硅是常见的物质。请回答下列问题。
(1)上述4种物质中属于盐的是______ (填序号,下同);水溶液能使紫色石蕊溶液变红的是______ 。
(2)写出盐酸的电离方程式___________。
(3)写出二氧化硅与氢氧化钠溶液反应的化学方程式_____________。
(4)碳酸氢钠可治疗胃酸(0.2%~0.4%的盐酸)过多,反应的离子方程式为_______。等物质的量的碳酸钠和碳酸氢钠与足量盐酸反应时生成CO2的量,前者_______后者(填“>”、“<”或“=”)。
(5)氯碱工业是以电解饱和食盐水为基础的基本化学工业。电解饱和食盐水的产物中一种是所有气体中密度最小的气体、一种是黄绿色气体和一种易溶、易电离的碱,则电解食盐水的化学方程式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,Ka (HCOOH)=1.77×10-4,Ka (CH3COOH)=1.75×10-5,Kb (NH3·H2O) =1.76×10-5,下列说法正确的是( )
A. 将CH3COONa溶液从20℃升温至30℃,溶液中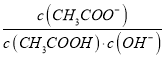 增大
增大
B. 用相同浓度的NaOH溶液分别滴定等体积pH均为3的HCOOH和CH3COOH溶液至终点,消耗NaOH溶液的体积相等
C. 0.2 mol/L HCOOH 与 0.1 mol/L NaOH 等体积混合后:c(HCOO-) + c(OH-) = c(HCOOH) + c(H+)
D. 0.2 mol/L CH3COONa 与 0.1 mol/L盐酸等体积混合后 (pH<7):c(CH3COO-) > c(Cl- ) >c(CH3COOH) >c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水资源的利用具有广阔的前景。从海水中提取Br2与MgCl2 6H2O的流程如下:
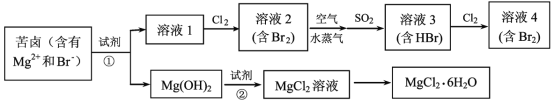
(1)写出一种海水淡化的方法_____。
(2)比较溶液中Br2的浓度:溶液2_____溶液4(填“>”或“<”)。
(3)鼓入空气与水蒸气将Br2吹出,吹出的气体用SO2吸收,其化学方程式是_______。
(4)试剂①可以选用__________,加入试剂②后反应的离子方程式是_________。
(5)从MgCl2溶液获得MgCl2 6H2O晶体的主要操作包括_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂用提取粗盐后的盐卤(主要成分为MgCl2)制备金属镁,其工艺流程如图。
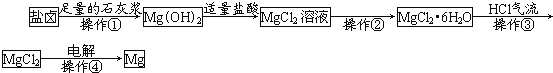
下列说法正确的是( )
A.操作①发生的反应为氧化还原反应
B.若在实验室进行操作①只需要漏斗和烧杯两种玻璃仪器
C.操作②是蒸发浓缩、冷却结晶
D.在整个制备过程中,发生复分解反应、氧化还原反应、分解反应、置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一容积为2 L的密闭容器内加入0.2 mol N2和0.6 mol H2,在一定条件下发生如下反应:N2(g)+3H2(g)![]() 2NH3 ΔH<0。反应中NH3的物质的量浓度的变化情况如图所示:
2NH3 ΔH<0。反应中NH3的物质的量浓度的变化情况如图所示:
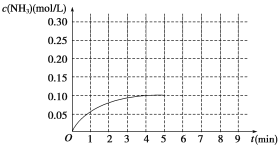
(1)根据图示,计算从反应开始到第4分钟达到平衡时,平均反应速率υ(N2)为__________。
(2)达到平衡后,第5分钟末,若保持其它条件不变,只改变反应温度,则NH3的物质的量浓度不可能为_____________。
a.0.20 mol/L b.0.12 mol/L c.0.10 mol/L d.0.08 mol/L
(3)达到平衡后,第5分钟末,若保持其它条件不变,只把容器的体积缩小,新平衡时NH3的浓度恰好为原来的2倍,则新体积_____(选填“大于”、“等于”、“小于”)二分之一倍的原体积,化学平衡常数________(选填“增大”、“减小”或“不变”)。
(4)在第5分钟末将容器的体积缩小一半,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25 mol/L)。请在图中画出第5分钟末到达新平衡时NH3浓度的变化曲线_____。
(5)已知拆开1mol H-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知五种短周期元素的原子序数的大小顺序为C>A>B>D>E;A、C同周期,B、C同主族;A与B形成的离子化合物A2B中,所有离子的电子数都相等,其电子总数为30;D和E可形成4核10电子分子。试回答下列问题:
(1)写出五种元素的名称:A__________,B__________,C________,D________,E________。
(2)用电子式表示离子化合物A2B的形成过程______________________
(3)写出D元素形成的单质的电子式____________。
(4)写出下列物质的电子式:B与E形成的化合物____;A、B、E形成的化合物________;D、E形成的4核10电子化合物__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示每一方框表示一种反应物或生成物,其中A、C、D、E、F在通常情况下均为气体,且加热X生成的A与C的物质的量之比为1∶1,B为常见液体。
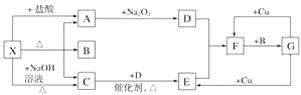
试回答下列问题:
(1)X是________(填化学式,下同),F是__________。
(2)A―→D反应的化学方程式为_______。
(3)G与Cu的反应中,G表现的性质为______。
(4)X与过量NaOH溶液反应生成C的离子方程式为_____________。
(5)以C、B、D为原料可生产G,若使amol C完全转化为G,理论上至少需要D___ mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com