
【题目】检验溴乙烷中的溴元素,不需要的试剂是
A. KOH溶液B. AgNO3溶液C. HNO3D. CCl4
科目:高中化学 来源: 题型:
【题目】(1)丙烯腈可用“丙烯氨氧化法”生产,生成丙烯腈的热化学方程式为:
CH2=CHCH3(g)+NH3(g)+3/2O2(g)= CH2=CHCN (g)+3H2O(g) △H=-515kJ/mol。该法在生产中有多种副产物生成,其中丙烯醛是主要副产物之一。若气态丙烯与氧气反应生成22.4g气态丙烯醛和水蒸汽,同时放出141.2kJ热量,则反应的热化学方程式为:______,该反应在任何温度下都能自发进行,其原因是______。
(2)图(a)为在某一时间段一密闭体系中生成丙烯腈的反应速率与反应进程的曲线关系。由图可知,t1时刻表示体系改变的反应条件为______;t2时刻表示体系改变的另一反应条件为______,此时平衡______移动(填“正向”、“逆向”或“不”)。

(3)图(b)为丙烯腈产率与反应温度的关系曲线,最高产率对应的温度为460℃ 。在相同的反应时间内,高于460℃时丙烯腈产率降低的可能原因是______(填序号)。
A.平衡常数变大
B.平衡常数变小
C.副反应增多
D.反应活化能增大
在相同的反应时间内.低于460℃时丙烯腈的产率______(填“是”或“不是”)对应温度下的平衡转化率,判断理由是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中所含的杂质(括号中是杂质),使用NaOH溶液不能除去的是
A. MgO固体(Al2O3) B. Na2CO3溶液(NaHCO3)
C. MgCl2溶液(AlCl3) D. ![]() (Br2)
(Br2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KMnO4是中学化学常见的试剂。
Ⅰ.某小组拟用酸性KMnO4溶液与H2C2O4(弱电解质)的反应来探究“外界条件对化学反应速率的影响”,并设计了如下的方案记录实验结果(忽略溶液混合体积变化)。限选试剂和仪器:0.20mol/L H2C2O4溶液、0.010mol/L KMnO4酸性溶液、蒸馏水、试管、量筒、秒表、恒温水浴槽
物理量 编号 | V(0.20 mol/L H2C2O4溶液)/mL | 甲 | V(0.010mol/L KMnO4溶液)/mL | M(MnSO4固体)/g | T/℃ | 乙 |
① | 2.0 | 0 | 4.0 | 0 | 50 | |
② | 2.0 | 0 | 4.0 | 0 | 25 | |
③ | 1.0 | a | 4.0 | 0 | 25 | |
④ | 2.0 | 0 | 4.0 | 0.1 | 25 |
回答下列问题:
(1)完成上述反应原理的离子反应方程式________
![]()
(2)上述实验①②是探究________对化学反应速率的影响;若上述实验②③是探究浓度对化学反应速率的影响,则表格中“甲”应填写________,a为________;
乙是实验需要测量的物理量,则表格中“乙”应填写________。
上述实验②④是探究________对化学反应速率的影响。
Ⅱ.某化学小组利用下图装置进行实验证明氧化性:KMnO4>Cl2>Br2。限选试剂:KBr溶液、KMnO4溶液、浓盐酸、浓硫酸
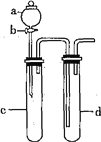
(3)装置a、d中盛放的试剂分别是:________、________;
(4)实验中观察到的现象为________________________________;
此实验装置的不足之处是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苹果汁是人们喜爱饮料,由于此饮料中含有Fe2+ , 现榨的苹果汁在空气中会由淡绿色变为棕黄色,若榨汁时加入维生素C,可有效防止这种现象发生.这说明维生素C具有( )
A.氧化性
B.还原性
C.碱性
D.酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用饱和氯化钠溶液润湿的滤纸分别做甲、乙两个实验,下列判断错误的是
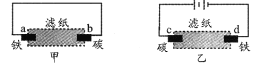
A. 甲是原电池,乙是电解池
B. 甲中铁棒比乙中铁棒更易腐蚀
C. d电极上的电极反应是:Fe-2e → Fe2+
D. b电极上的电极反应是:O2 + 2H2O + 4e → 4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是在相同温度下,三种酸的一些数据,下列说法正确的是

A.相同温度下,从HX的数据可以说明:弱电解质溶液浓度越低,电离度越大,且K1>K2>K3=0.1
B.室温时,若在NaZ溶液中加水,则c(Z-)/[c(HZ)×c(OH-)]的比值变小,若加少量盐酸,则比值变大
C.等物质的量的NaX、NaY和NaZ的混合,c(X-)+c(Y-)-2c(Z-)=2c(HZ)-c(HX)-c(HY),且c(Z-)<c(Y-)<c(X-)
D.相同温度下,K5>K4>K3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,把2.5 mol A和2.5 mol B混合盛入容积为2 L的密闭容器里,发生如下反应:3A(g)+B(s)![]() x C(g)+2D(g),经5 s反应达平衡,在此5 s内C的平均反应速率为0.2 mol·L-1·s-1,同时生成1 mol D,下列叙述中不正确的是
x C(g)+2D(g),经5 s反应达平衡,在此5 s内C的平均反应速率为0.2 mol·L-1·s-1,同时生成1 mol D,下列叙述中不正确的是
A. 反应达到平衡状态时A的转化率为60%
B. x=4
C. 反应达到平衡状态时,相同条件下容器内气体的压强与起始时压强比为6∶5
D. 若混合气体的密度不再变化,则该可逆反应达到化学平衡状态
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com