
����Ŀ����1����ϩ����á���ϩ�������������������ɱ�ϩ����Ȼ�ѧ����ʽΪ��
CH2=CHCH3(g)+NH3(g)+3/2O2(g)= CH2=CHCN (g)+3H2O(g) ��H=-515kJ/mol���÷����������ж��ָ���������,���б�ϩȩ����Ҫ������֮һ������̬��ϩ��������Ӧ����22.4g��̬��ϩȩ��ˮ������ͬʱ�ų�141.2kJ����,��Ӧ���Ȼ�ѧ����ʽΪ��______���÷�Ӧ���κ��¶��¶����Է����У���ԭ����______��
��2��ͼ��a��Ϊ��ijһʱ���һ�ܱ���ϵ�����ɱ�ϩ��ķ�Ӧ�����뷴Ӧ���̵����߹�ϵ����ͼ��֪��t1ʱ�̱�ʾ��ϵ�ı�ķ�Ӧ����Ϊ______��t2ʱ�̱�ʾ��ϵ�ı����һ��Ӧ����Ϊ______����ʱƽ��______�ƶ��������������������

��3��ͼ(b)Ϊ��ϩ������뷴Ӧ�¶ȵĹ�ϵ���ߣ���߲��ʶ�Ӧ���¶�Ϊ460�� ������ͬ�ķ�Ӧʱ���ڣ�����460��ʱ��ϩ����ʽ��͵Ŀ���ԭ����______������ţ���
A��ƽ�ⳣ�����
B��ƽ�ⳣ����С
C.����Ӧ����
D����Ӧ�������
����ͬ�ķ�Ӧʱ���ڣ�����460��ʱ��ϩ��IJ���______����ǡ����ǡ�����Ӧ�¶��µ�ƽ��ת���ʣ��ж�������_________��
���𰸡� C3H6(g) +O2(g) ==== C3H4O(g) +H2O(g) ��H = 353 kJ��mol1 �÷�Ӧ���ȣ����ر�Ϊ0���κ��¶��¦�G��С��0���������κ��¶��¿����Է��� ʹ���˴��� ���� ���� BC ���� �÷�ӦΪ���ȷ�Ӧ��ƽ�����Ӧ���¶����߶�����
����������1��22.4g��̬��ϩȩ�����ʵ���Ϊ![]() =0.4mol��������1mol C3H4O�ų�����141.2kJ��
=0.4mol��������1mol C3H4O�ų�����141.2kJ��![]() =353 kJ����Ӧ���Ȼ�ѧ����ʽΪC3H6(g) +O2(g) ==== C3H4O(g) +H2O(g) ��H = 353 kJ��mol1���÷�Ӧ���ȣ����ر�Ϊ0���κ��¶��¦�G��С��0���������κ��¶��¿����Է����ʴ�Ϊ��C3H6(g) +O2(g) ==== C3H4O(g) +H2O(g) ��H = 353 kJ��mol1���÷�Ӧ���ȣ����ر�Ϊ0���κ��¶��¦�G��С��0���������κ��¶��¿����Է���
=353 kJ����Ӧ���Ȼ�ѧ����ʽΪC3H6(g) +O2(g) ==== C3H4O(g) +H2O(g) ��H = 353 kJ��mol1���÷�Ӧ���ȣ����ر�Ϊ0���κ��¶��¦�G��С��0���������κ��¶��¿����Է����ʴ�Ϊ��C3H6(g) +O2(g) ==== C3H4O(g) +H2O(g) ��H = 353 kJ��mol1���÷�Ӧ���ȣ����ر�Ϊ0���κ��¶��¦�G��С��0���������κ��¶��¿����Է���
��2����ͼ��֪��t1ʱ�̣���Ӧ���ʼӿ죬��ƽ�ⲻ�ƶ�����ʹ���˴�����t2ʱ�̣���Ӧ���ʼ�����ƽ�ⷢ�����ƶ���˵���������¶Ȼ��Сѹǿ������ǽ����¶ȣ�ƽ�������ƶ�������Ǽ�Сѹǿ�����ݷ���ʽ��ƽ�ⲻ�ƶ�����˸ı�������ǽ����¶ȣ��ʴ�Ϊ��ʹ���˴��������£�����
��3��A���÷�Ӧ���ȣ������¶ȣ�ƽ�������ƶ���ƽ�ⳣ����С������ B���÷�Ӧ���ȣ������¶ȣ�ƽ�������ƶ���ƽ�ⳣ����С����ȷ��C.�����¶ȣ�����Ӧ���࣬���� ���ʽ��ͣ���ȷ��D����Ӧ������¶��أ�����ѡBC���÷�ӦΪ���ȷ�Ӧ��ƽ�����Ӧ���¶����߶����ͣ���˵���460��ʱ��ϩ��IJ��ʲ��Ƕ�Ӧ�¶��µ�ƽ��ת���ʣ��ʴ�Ϊ��BC�����ǣ� �÷�ӦΪ���ȷ�Ӧ��ƽ�����Ӧ���¶����߶����͡�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��Ԫ�����ڱ���һ����
�� | |||||||||||||||||
�� | �� | �� | �� | ||||||||||||||
�� | �� | �� | |||||||||||||||
�� | �� |
��1��Ԫ�آ����Χ���ӵĵ����Ų�ͼΪ________��Ԫ�آ�ԭ�ӽṹʾ��ͼΪ____________
��2��Ԫ�آۢܢݵĵ縺���ɴ�С��˳��Ϊ____________���ѧ�����ͬ�������һ�������ɴ�С��˳��Ϊ_______________��������Ӱ뾶�ɴ�С��˳��Ϊ_______________��
��3��������¶Ƚӽ�373K��100����ʱ������M=m/n�ⶨ�ݵ���̬�⻯�����Է���������������ֲⶨ���������ֵ�ߣ���ԭ����_________________��
��4��ijЩ��ͬ��Ԫ�ص�����Ҳ��һ���������ԣ����ϱ���Ԫ�آ���Ԫ�آڵ��������������Ƶ����ʡ�д��Ԫ�آڵ�����������ˮ������NaOH��Һ��Ӧ�����ӷ���ʽ________________��
��5��������������Ԫ�صĵ�һ�����ĵ��������ݣ���λ��kJ��mol-1�����ش�������⣺
Ԫ�ش��� | I1 | I2 | I3 | I4 |
Q | 2080 | 4000 | 6100 | 9400 |
R | 500 | 4600 | 6900 | 9500 |
S | 740 | 1500 | 7700 | 10500 |
T | 580 | 1800 | 2700 | 11600 |
U | 420 | 3100 | 4400 | 5900 |
�������ڱ��У�����ܴ���ͬһ�������____________������Ԫ�ش��ţ�
��TԪ���������______���s������p������d������ds���ȣ���Ԫ�أ���TΪ�ڶ�����Ԫ�أ�Z�ǵ�������Ԫ����ԭ�Ӱ뾶��С������Ԫ�أ���T��Z�γɵĻ�������Ӽ���Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ���ܺ�Cl����CO32����SO42����SiO32����Cu2����Ba2����Na����̽��С��Ϊ��ȷ������Һ�����ӵ���ɣ�ȡ����Һ100mL��������ʵ��: �������NaOH��Һ���õ�29.4g��ɫ���������ˣ���������Һ�м�����Ba(NO3)2��Һ���õ�46.6g������ϡ����ij�����������˵����ȷ���ǣ�
A. ��Һ�п϶���SO42����Cu2����һ��û��Ba2�����������Ӳ���ȷ��
B. ��Һ�п϶���SO42����Cu2����������Na����Cl��
C. ��Һ�п϶���SO42����Cu2����Cl����������Na��
D. ��Һ�����ͬʱ��Na����Cl������C(Na��)> C(Cl��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�����У�ҪʹAlCl3��Һ�е�Al3+����ȫ�����������������õ��Լ��ǣ� ��
A.NaOH��Һ
B.Ba��OH��2��Һ
C.����
D.��ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NA��ʾ����٤��������ֵ������������ȷ���ǣ� ��
A. 1mol ��CH3�������к��еĵ�����Ϊ10NA
B. ��״���£�22.4 L C3H8�к����ۼ�����ĿΪ8 NA
C. ��״���£�22.4 L���к�C��H��ĿΪ6 NA
D. 184g �������������Ʒ�Ӧ����H2����ĿΪ3 NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ҵ��ͼױ�Ϊԭ�ϣ��ɰ�����·�ߺϳɷ���ʽ��ΪC9H10O2���л�������ƷE��J��
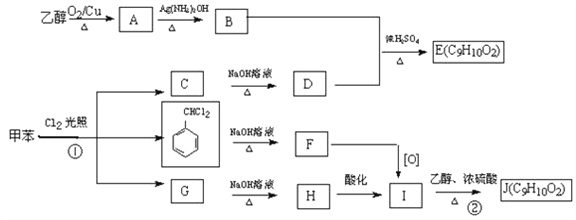
��֪��
��ش�
(1)д�����з�Ӧ����ʽ
��B+D��E______��
��G��H______��
(2)�ڵķ�Ӧ����Ϊ______��F�Ĺ���������Ϊ______��
(3)E��J�ж���ͬ���칹�壬��������������ͬ���칹����______�֣�
����E��J��ͬ�����ʢڱ�����������ȡ�����ұ����ϵ�һ�ȴ���ֻ�����֡�
д���������ˮ���������FeCl3��Һ������ɫ��Ӧ�Ľṹ��ʽ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����в�ҩ������п����һ��������Ч�ɷ֡������ǻ�����ͪ������һ��ֵ�ý�һ���о�Ӧ�õ�ҩ��ƶϸ����ʲ����еĻ�ѧ������
![]()
A. ����NaOH��Һ��Ӧ B. ������ˮ��Ӧ
C. ����Na2CO3��Һ��Ӧ D. �ڴ����������ܱ������ɺ����ǻ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������е���Ԫ�أ�����Ҫ���Լ���
A. KOH��ҺB. AgNO3��ҺC. HNO3D. CCl4
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com