
氧化铜矿中含有主要杂质为Fe2+和Al3+等,用其生产CuSO4·5H2O主要工艺流程如下图。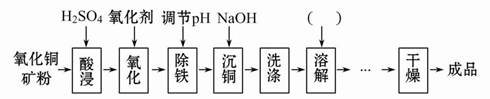
(1)图中加入氧化剂的目的是 ,结合下表回答除铁步骤的最佳pH范围为 。
(2)氧化剂若选用KMnO4,会降低产品的纯度,其原因是 ,实际生产中NaClO作为最佳氧化剂,发生反应的离子方程式为 。
(3)请在下图中完善所缺步骤及所添加试剂的化学式。可供选择的操作有:萃取、蒸发浓缩、过滤、洗涤、降温结晶、蒸馏、分液。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
用含有A1203、SiO2和少量FeO·xFe2O3的铝灰制备A12(SO4)3·18H2O。工艺流程如下:
(一定条件下,MnO4 - 可与Mn2+反应生成MnO2)
已知:生成氢氧化物沉淀的pH
| | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀时 | 3.4 | 6.3 | 2.7 |
| 完全沉淀时 | 5.2 | 9.7 | 3.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
稀土元素是周期表中Ⅲ B族钪、钇和镧系元素的总称,它们都是很活泼的金属,性质极为相似,常见化合价为+3。其中钇(Y)元素是激光和超导的重要材料。我国蕴藏着丰富的钇矿石( Y2FeBe2Si2O10),以此矿石为原料生产氧化钇(Y2O3)的主要流程如下:
已知:I.有关金属离子形成氢氧化物沉淀时的pH如下表:
| | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe3+ | 2.7 | 3.7 |
| Y3+ | 6.0 | 8.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
海水是宝贵的自然资源.利用海水水可以得到一系列产品.也可以进行废气处理。
(1)利用氯碱工业产品处理含SO2的烟气的流程如下: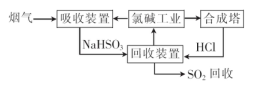
①“吸收装置”中发生反应的离子方程式是 .
②上述流程中循环利用的物质是 。
(2)利用海水脱硫可以有效地解决煤燃烧排放的SO2造成的一系列环境问题。其工艺流程如图所示: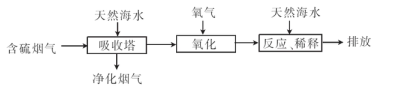
天然海水吸收含硫的烟气后.需要用氧气进行氧化处理.其反应原理的化学方程式是 ;氧化后的海水需要加入氢氧化钠.与之混合后才能排放.该操作的主要目的是 。
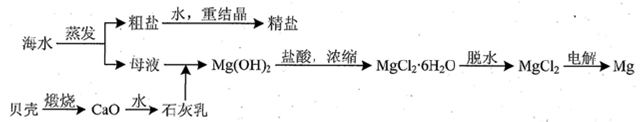
(3)从海水中捉纯粗盐后的母液中含有K+、Na+、Mg2+等阳离子.对母液进行一系列的加工可制得金属镁。
①从离子反席的角度思考.在母液中加入石灰乳所起的作用是 。
②要利用MgCl2·6H2O制得尢水氯化镁.应采取的措施是 。
③电解熔融的无水氯化镁所得的镁蒸气在特定的环境中冷却后即为固体镁.下列物质中可以用作镁蒸气的冷却剂的是 (填字母)。
A.Ar B.CO2 C 空气 D.O2 E.水蒸气
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
海洋是生命的摇篮、资源的宝库。中国要实施海洋强国战略,实现由海洋大国向海洋强国迈进的梦想。海洋经济已经成为拉动我国国民经济发展的重要引擎,海水的综合开发、利用是海洋经济的一部分,海水中可提取多种化工原料,下面是工业上对海水的几项综合利用的示意图。其流程如下图所示:
(1)写出①、②反应的离子方程式:
①______________________,②______________________。
(2)工业上利用电解饱和食盐水产生的氢气和氯气制取盐酸,为了体现绿色化学理念,使氯气充分反应,采取将氯气在氢气中燃烧的办法,可避免氯气燃烧不完全污染空气,请写出氯气在氢气中燃烧的实验现象:______________________。
(3)粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制后可得到饱和NaC1溶液。现有下列除杂试剂:A.盐酸 B.氢氧化钡溶液 C.碳酸钠溶液。精制时加入过量除杂试剂的正确顺序是______________。(填序号)
(4)金属镁在空气中燃烧时,除生成MgO外,还有少量Mg3N2生成。把等物质的量的金属镁分别放在:A.纯氧气(O2)中;B.二氧化碳气体中;C.空气中。完全燃烧后,得到的固体物质的质量由大到小的顺序是______________。(填序号)
(5)将电解饱和NaCl溶液生成的氯气通入氢氧化钠溶液中可以得到NaClO。某化学兴趣小组探究NaClO与尿素CO(NH2)2的反应产物,通过实验发现产物除某种盐外,其余产物都是能参与大气循环的物质,则该反应的化学方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
苯甲酸广泛应用于制药和化工行业。某化学小组用甲苯作主要原料制备苯甲酸,反应过程如下:
甲苯、苯甲酸钾、苯甲酸的部分物理性质见下表:
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 在水中溶解性 |
| 甲苯 | -95 | 110.6 | 0.8669 | 难溶 |
| 苯甲酸钾 | 121.5~123.5 |  |  | 易溶 |
| 苯甲酸 | 122.4 | 248 | 1.2659 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
海水中主要离子的含量如下:
| 成分 | 含量/(mg/L) | 成分 | 含量/(mg/L) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3- | 142 |
| SO42- | 2560 | Mg2+ | 1272 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
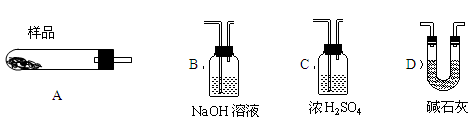
蛇纹石矿可以看作由MgO、Fe2O3、Al2O3、SiO2组成,由蛇纹石制取碱式碳酸镁的实验步骤如下:
(1)蛇纹石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是 。
(2)进行Ⅰ操作时,控制溶液的pH=7~8(有关氢氧化物沉淀的pH见下表),Ca(OH)2不能过量,若Ca(OH)2过量可能会导致 溶解,产生 沉淀。
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 9.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
银铜合金广泛应用于航空工业。从切割废料中回收银并制备铜的化工产品CuAlO2的工艺如下:(注:Al(OH)3和Cu(OH)2开始分解的温度分别为450℃和80℃)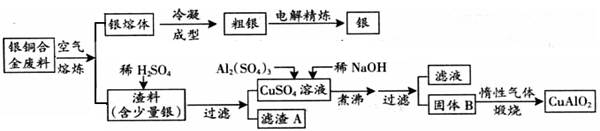
(1)铜的核外电子排布式为 .
(2)电解精炼银时,阴极反应式为 滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,该气体变色的化学方程式为 .
(3)固体混合物B的组成为 ;在生成固体B的过程中,需控制NaOH的加入量,若NaOH过量,最后将得不到CuAlO2 ,写出因NaOH过量引起的反应的离子方程式 .
(4)若将上述流程图中加入的稀NaOH溶液改为加入过量的氨水(其它均不变),则滤液中的阳离子有 .
(5)完成上述煅烧过程中一个反应的化学方程式:
CuO + Al2O3 Cu AlO2 + (系数1也要写).
Cu AlO2 + (系数1也要写).
(6)若银铜合金中铜的质量分数为64%,理论上5.0kg废料中的铜可完全转化为CuAlO2,至少需要1.0mol·L-1的Al2(SO4)3溶液 L .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com