
【题目】向碳酸溶液中滴加NaOH溶液,测得碳酸中含碳微粒的物质的量分数随pH变化如图所示,下列说法不正确的是:

A.除去NaCl溶液中Na2CO3的方法是向其中加入盐酸至pH=7
B.X、Y为曲线两交叉点。由X点处的pH,可计算Ka1(H2CO3)
C.pH=10的溶液中c(H+)+c(Na+)=c(HCO3-)+2 c(CO32-)+c(OH-)
D.将CO2通入NaOH溶液制取Na2CO3,应控制pH>12.5
【答案】A
【解析】
A.由图像可知,当pH=7时含碳微粒主要为H2CO3和HCO3-,而pH约为3.5时,主要以碳酸形式存在,故要除去NaCl溶液中Na2CO3,需要调节pH小于3.5左右,故A错误;
B.Ka1(H2CO3)=![]() ,根据图像,X点处c(HCO3-)= c(H2CO3),此时Ka1(H2CO3)= c(H+),因此由X点处的pH,可计算Ka1(H2CO3),故B正确;
,根据图像,X点处c(HCO3-)= c(H2CO3),此时Ka1(H2CO3)= c(H+),因此由X点处的pH,可计算Ka1(H2CO3),故B正确;
C.根据图像,pH=10的溶液中存在碳酸氢钠和碳酸钠,溶液中存在电荷守恒:c(H+)+c(Na+)=c(HCO3-)+2 c(CO32-)+c(OH-),故C正确;
D.根据图像,pH>12.5含碳微粒主要以碳酸根离子形式存在,将CO2通入NaOH溶液制取Na2CO3,应控制pH>12.5,故D正确;
答案选A。


科目:高中化学 来源: 题型:
【题目】温度为T时,向2.0L恒容密闭容器中充入1.0molA,反应A(g)===B(g)+C(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表:下列说法正确的是
t/s | 0 | 50 | 150 | 250 | 350 |
n(B)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
A. 反应在前50s的平均速率v(B)=0.0032mol·L-1·s-1
B. 保持其他条件不变,升高温度,平衡时c(B)=0.11mol·L-1,则反应的ΔH<0
C. 相同温度下,起始时向容器中充入1.0mol A、0.20mol B和0.20mol C,反应达到平衡前v正<v逆
D. 相同温度下,起始时向容器中充入2.0mol B和2.0mol C,达到平衡时,B的转化率大于80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制备氮化硅的反应为:3SiCl4(g)+2N2(g)+6H2(g)![]() Si3N4(s)+12HCl(g) ΔH<0,将0.3 mol SiCl4 和一定量 N2、H2 投入2 L反应容器,只改变温度条件测得Si3N4的质量变化如下表:
Si3N4(s)+12HCl(g) ΔH<0,将0.3 mol SiCl4 和一定量 N2、H2 投入2 L反应容器,只改变温度条件测得Si3N4的质量变化如下表:

下列说法正确的是( )
A.250 ℃,前2 min, Si3N4 的平均反应速率为0.02 mol·L-1·min-1
B.反应达到平衡时, 两种温度下 N2 和 H2 的转化率之比相同
C.达到平衡前,300 ℃条件的反应速率比250 ℃快; 平衡后,300 ℃比250 ℃慢
D.反应达到平衡时, 两种条件下反应放出的热量一样多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为分析某盐的成分, 做了如下实验:
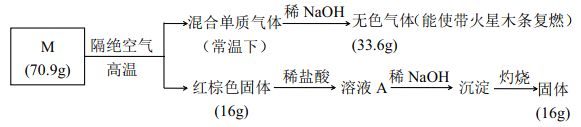
请回答:
(1)盐 M 的化学式是_________;
(2)被 NaOH 吸收的气体的电子式____________;
(3)向溶液 A 中通入H2S 气体, 有淡黄色沉淀产生, 写出反应的离子方程式________ (不考虑空气的影响)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硫的化合物的说法正确的是
A.在燃煤中加入石灰石可减少SO2排放,发生的反应为2CaCO3+2SO2+O2![]() 2CO2+2CaSO4
2CO2+2CaSO4
B.把 SO2 通入酸性高锰酸钾溶液可验证SO2的漂白性
C.浓硫酸能使纸张变黑,这是因为纸张中的纤维素是碳水化合物,浓硫酸吸收了其中的水分
D.SO2具有较强的还原性,浓硫酸有强氧化性,所以不能用浓硫酸干燥 SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.浓硫酸和浓硝酸都具有强氧化性,都能把 HCl 气体氧化
B.非金属氧化物不一定是酸性氧化物,金属氧化物多数是碱性氧化物
C.同温同压下,两份相同质量的锌粉,分别与足量的稀硫酸和浓硫酸反应,产生气体的体积相同
D.将 CO2 气体通入BaCl2 溶液中至饱和未见沉淀生成,继续通入 NH3 则有沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中是A、B、C、D、E五种短周期元素的某些性质,下列判断正确的是

A. C、D、E 的氢化物的稳定性:C>D>E
B. 元素 A 的原子最外层轨道中无自旋状态相同的电子
C. 元素 C、D 之间不可能形成化合物
D. 与元素 B 同周期且第一电离能最小的元素的单质能与 H2O 发生置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是一种高效安全消毒剂,常温下
是一种高效安全消毒剂,常温下![]() 为红黄色有刺激性气味气体,其熔点为-59.5℃,沸点为11.0℃,能溶于水但不与水反应,遇热水缓慢水解。某研究性学习小组欲制备
为红黄色有刺激性气味气体,其熔点为-59.5℃,沸点为11.0℃,能溶于水但不与水反应,遇热水缓慢水解。某研究性学习小组欲制备![]() 水溶液并检验其性质。
水溶液并检验其性质。
Ⅰ.二氧化氯水溶液制备。

在圆底烧瓶中先放入![]() 固体和
固体和![]() ,然后再加入5mL稀硫酸,用磁力搅拌棒搅拌(如图),将烧瓶放在热水浴中,保持60℃~80℃,至B中广口瓶内呈深红黄色时停止加热。回答下列问题:
,然后再加入5mL稀硫酸,用磁力搅拌棒搅拌(如图),将烧瓶放在热水浴中,保持60℃~80℃,至B中广口瓶内呈深红黄色时停止加热。回答下列问题:
(1)装置A用水浴加热的优点是_________;装置A中水浴温度不低于60℃,其原因是_______________。
(2)装置A中反应生成![]() 及
及![]() 等产物的化学方程式为_____________________;
等产物的化学方程式为_____________________;
(3)装置B的水中需放入冰块的目的是__________________;已知![]() 缓慢水解生成的含氯化合物只有
缓慢水解生成的含氯化合物只有![]() 和
和![]() ,且物质的量之比为2:1,则该反应的化学方程式为____________;装置C中的
,且物质的量之比为2:1,则该反应的化学方程式为____________;装置C中的![]() 溶液吸收尾气中的
溶液吸收尾气中的![]() ,生成物质的量之比为的1:1的两种盐,一种为
,生成物质的量之比为的1:1的两种盐,一种为![]() ,另一种为_________________。
,另一种为_________________。
Ⅱ.![]() 的含量测定
的含量测定
步骤1:量取![]() 溶液
溶液![]() ,稀释成
,稀释成![]() 试样;量取
试样;量取![]() 试样加入到锥形瓶中;
试样加入到锥形瓶中;
步骤2:调节试样的![]() ,加入足量的
,加入足量的![]() 晶体,振荡后,静置片刻;
晶体,振荡后,静置片刻;
步骤3:加入指示剂,用![]() 溶液滴定至终点,消耗
溶液滴定至终点,消耗![]() 溶液
溶液![]() 。
。
(4)已知:![]() ,
,![]() ,原
,原![]() 溶液的浓度为_____
溶液的浓度为_____![]() (用含字母的代数式表示),如果滴定速度过慢,会使计算出的数值______(填“偏大”、“偏小”或“不变”)。
(用含字母的代数式表示),如果滴定速度过慢,会使计算出的数值______(填“偏大”、“偏小”或“不变”)。
Ⅲ.设计实验验证![]() 的氧化性
的氧化性
(5)取适量![]() 水溶液加入
水溶液加入![]() 溶液中,振荡,得无色溶液。欲检验
溶液中,振荡,得无色溶液。欲检验![]() 的氧化产物,还需要用到的试剂是____________。
的氧化产物,还需要用到的试剂是____________。
(6)证明![]() 的氧化性比
的氧化性比![]() 强的方案是__________________________________。
强的方案是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=1的两种酸溶液A、B各1mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图所示,下列说法不正确的是

A. A、B两种酸溶液的物质的量浓度一定相等
B. 稀释后,A酸溶液的酸性比B酸溶液的酸性弱
C. 若a=4,则A是强酸,B是弱酸
D. 若1<a<4,则A、B都是弱酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com