
【题目】钴的化合物在工业生产、生命科技等行业有重要应用。
(1)Co2+的核外电子排布式为_______,Co的第四电离能比 Fe 的第四电离能要小得多,原因是__________________________。
(2)Co2+ 、Co3+都能与 CN一形成配位数为6的配离子。CN一中碳原子的杂化方式为____________;HCN分子中含有![]() 键的数目为__________________。
键的数目为__________________。
(3)用KCN处理含Co2+的盐溶液 ,有红色的Co(CN)2 析出,将它溶于过量的KCN溶液后,可生成紫色的[Co(CN)6] 4- ,该配离子是一种相当强的还原剂,在加热时能与水反应生成[Co(CN )6]3-,写出该反应的离子方程式:_______________。
(4)金属钴的堆积方式为六方最密堆积,其配位数是 _____。有学者从钴晶体中取出非常规的“六棱柱”晶胞,结构如图所示,该晶胞中原子个数为_____,该晶胞的边长为a nm,高为c nm,该晶体的密度为___gcm-3(NA表示阿伏加德罗常数的值,列出代数式)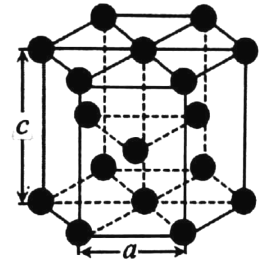
【答案】![]() 钴原子失去4个电子后可以得到
钴原子失去4个电子后可以得到![]() 的稳定结构,因此更容易失去第4个电子,表现为第四电离能较小 sp 2
的稳定结构,因此更容易失去第4个电子,表现为第四电离能较小 sp 2 ![]() 12 6
12 6 
【解析】
(1)钴是27号元素,其电子排布为![]() ,再来分析即可;
,再来分析即可;
(2)碳原子最外层有4个电子,需要成4个键才能达到稳定结构,氮原子最外层有5个电子,需要成3个键才能达到稳定结构,而氢原子只能成1个键,据此不难推出![]() 的结构为
的结构为![]() ,再来分析其碳原子的杂化方式和
,再来分析其碳原子的杂化方式和![]() 键的数目即可;
键的数目即可;
(3)注意一个![]() 带-1价,因此该反应的实质相当于钴从+2价被氧化为+3价,水中自然只有氢能被还原,从+1价被还原为0价的单质;
带-1价,因此该反应的实质相当于钴从+2价被氧化为+3价,水中自然只有氢能被还原,从+1价被还原为0价的单质;
(4)根据观察,每个钴原子的配位数为12,即周围一圈6个,上、下各3个,而晶体密度只需按照![]() 来构造公式即可。
来构造公式即可。
(1)钴的电子排布式为![]() ,钴原子失去4个电子后可以得到
,钴原子失去4个电子后可以得到![]() 的稳定结构,因此更容易失去第4个电子,表现为第四电离能较小;
的稳定结构,因此更容易失去第4个电子,表现为第四电离能较小;
(2)![]() 为直线型分子,因此其碳原子的杂化方式为
为直线型分子,因此其碳原子的杂化方式为![]() 杂化,而1个
杂化,而1个![]() 分子中有2个
分子中有2个![]() 键和2个
键和2个![]() 键;
键;
(3)根据分析,反应方程式为![]() ;
;
(4)根据分析,钴原子的配位数为12,在计算一个晶胞中的原子数时,12个顶点上的原子按![]() 算,上下表面面心的原子按
算,上下表面面心的原子按![]() 算,体内的按1个算,因此一个晶胞内一共有
算,体内的按1个算,因此一个晶胞内一共有![]() 个原子;而晶体密度为
个原子;而晶体密度为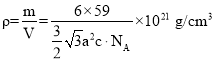 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列有关电化学原理的说法正确的是
A.用惰性电极电解MgCl2饱和溶液可制得金属镁
B.用惰性电极电解CuCl2溶液时,阳极表面生成红色物质
C.在铁钉表面电镀铜时,将铁钉作阳极,铜作阴极,硫酸铜溶液为电解质
D.用石墨电极电解饱和食盐水的过程中,溶液的pH逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)卤族元素组成的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识它们。
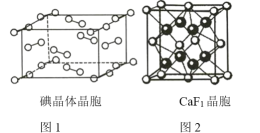
①如图1为碘晶体的晶胞结构。有关说法正确的是_________(填序号)。
a.平均每个晶胞中有4个碘分子
b.平均每个晶胞中有4个碘原子
c.碘晶体为无限延伸的空间结构,是原子晶体
d.碘晶体中存在的相互作用有非极性键和范德华力
②已知CaF2晶胞(图2)的密度为ρ g/cm3,NA表示阿伏加德罗常数的值,棱上相邻的两个Ca2+的核间距为a cm,则CaF2的摩尔质量可表示为_________________。
(2)以MgCl2为原料用电解熔融盐法制备镁时,常加入NaCl、KCl或CaCl2等金属氯化物,其主要作用除了降低熔点之外,还有_______________。
(3)有研究表明,化合物X可用于研究模拟酶,当结合 或Cu(I)(I表示化合价为+1)时,分别形成如下图所示的A和B:
或Cu(I)(I表示化合价为+1)时,分别形成如下图所示的A和B:

①A中连接相邻含N杂环的碳碳键可以旋转,说明该碳碳键具有_________键的特性。
②微粒间的相互作用包括化学键和分子间相互作用,比较A和B中微粒间相互作用力的差异:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅铬黄是一种颜料,主要成分是铬酸铅PbCrO4。现以CrCl36H2O 和 Pb(NO 3)2等为原料制备该物质,并测定产物纯度。
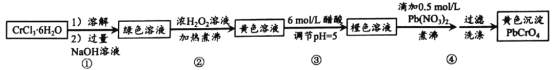
(1)溶解、过滤、洗涤操作时, 均需要用到的以下仪器为______________(填标号)。

(2)第①步所得绿色溶液的主要成分为 NaCrO2,已知 Cr(OH)3 不溶于水,与Al(OH)3类似,具有两性。写①步发生反应的离子方程式_____________________。
(3)第②步中加入H2O2 浓溶液的目的是___________________。溶液逐步变为亮黄色后,仍须持续煮沸溶液一段时间,目的是_____________________。
(4)第③步加入醋酸的目的是,防止pH 较高时,加入 Pb(NO3)2 溶液会产生______(填化学式)沉淀,影响产率。利用pH 试纸,调节 pH 的实验操作是_____________。pH逐步降低时, 溶液中的CrO42-转化为 ____________离子(填化学式)。
(5)由于铬酸铅的溶解度比重铬酸铅的小的多,在第④ 步中逐滴滴加 Pb(NO3)2溶液后,产PbCrO4黄色沉淀, 此时为了提高铅铬黄的产率,可补加少量NaOH溶液,请用化学平衡移动原理加以解释:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得到的结论正确的是( )
选项 | 实验操作和现象 | 结 论 |
A | 含有酚酞的Na2CO3溶液中加入少量BaCl2固体,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
B | 用铂丝蘸取少量NaCl溶液进行焰色反应,火焰呈黄色 | 这是钠离子的发射光谱 |
C | NaI溶液 | 酸性条件下H2O2的氧化性比I2强 |
D | 向浓度均为0.1 mol·L-1的NaCl和NaI混合溶液中滴加少量AgNO3溶液,先出现黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,浓度均为0.1 mol/L体积均为V0的HA、HB溶液分别加水稀释至体积为 V的溶液。稀释过程中,pH与![]() 的变化关系如图所示。下列叙述正确的是
的变化关系如图所示。下列叙述正确的是
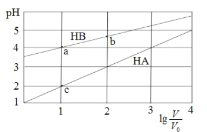
A.pH 随 ![]() 的变化始终满足直线关系
的变化始终满足直线关系
B.溶液中水的电离程度:a > b > c
C.该温度下,Ka(HB)≈ 10-6
D.分别向稀释前的HA、HB溶液中滴加 NaOH 溶液至 pH = 7 时,c(A-)= c(B-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,给一氧化碳和水蒸气的气体混合物加热,在催化剂存在下发生反应:CO(g)+H2O(g)![]() H2(g)+CO2(g)。在500 ℃时,平衡常数K=9。若反应开始时,一氧化碳和水蒸气的浓度都是0.02 mol/L,则在此条件下CO的转化率为( )
H2(g)+CO2(g)。在500 ℃时,平衡常数K=9。若反应开始时,一氧化碳和水蒸气的浓度都是0.02 mol/L,则在此条件下CO的转化率为( )
A. 25% B. 50% C. 75% D. 80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CPAE是蜂胶的主要活性成分,也可由咖啡酸合成,下列说法不正确的是( )

A. 1mol CPAE与足量的溴水反应,最多消耗4mol Br2
B. 咖啡酸可发生聚合反应,而且其分子中含有3种官能团
C. 与苯乙醇互为同分异构体的酚类物质共有9种
D. 可用金属Na检测上述反应是否残留苯乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机物的结构简式如图所示,下列有关该物质的说法正确的是( )
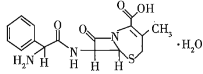
A.在一定条件下,该物质能发生水解反应生成氨基酸
B.1 mol该物质最多能与7 mol H2发生加成反应
C.该物质能与碳酸钠反应,不能与盐酸反应
D.该物质不能使溴水褪色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com