
【题目】科学家合成了一种新化合物(如图所示),其中X、Y是第三周期的非金属元素,各原子均满足8电子稳定结构。
完成下列填空:

(1)硅原子最外电子层有________种运动状态不同的电子,占据______个轨道。
(2)由题意可推知Y是Cl,推得此结论的依据是__________________。X和Si之间共用电子对偏离________。
(3)SiCl4和CCl4分子空间结构相同,则SiCl4中键角是_________。请说明SiCl4和CCl4沸点高低的理由。__________________________________________。
(4)黄磷(P4)与过量浓NaOH溶液反应,产生PH3和次磷酸钠(NaH2PO2),补全并配平该反应的化学方程式,标出电子转移的数目和方向:_____P4+_____NaOH+_________→_____PH3↑+_____NaH2PO2,____________________.其中氧化剂和还原剂质量比为________。根据题意可判断H3PO2是________元酸(填“一”、“二”或“三”)。
(5)已知磷酸二氢钠(NaH2PO4)溶液呈酸性,该溶液中含磷元素的离子浓度由大到小的顺序是:__________________________________________。
【答案】4 3 Y在第三周期,且Y 和Si 间只有一根共价键 Si 109°28′ SiCl4 的熔点比CCl4 高,SiCl4 和CCl4 是组成和结构相似的分子晶体,SiCl4 的相对分子质量大,分子间作用力强,故SiCl4 的熔点高 1 3 3H2O 1 3 ![]() 1:3 一 c (H2PO4﹣) > c (HPO42﹣) > c (PO43﹣)
1:3 一 c (H2PO4﹣) > c (HPO42﹣) > c (PO43﹣)
【解析】
(1)Si原子的电子排布式为1s22s22p63s23p2,最外层含有4个电子,4个电子的运动状态均不同;
(2)Y 和Si 间只有一根共价键且在第三周期,则Y是Cl;X周围连接了2根共价键,又在第三周期,则X是S元素;
(3) SiCl4和CCl4分子空间结构相似;
(4)黄磷(P4)与过量浓NaOH溶液反应,产生PH3和次磷酸钠(NaH2PO2),P的化合价由0价下降到-3价,同时又从0价上升到+1价,P4既是氧化剂又是还原剂,还原产物PH3 和氧化产物NaH2PO2的系数比为1:3,该反应共转移电子3个,配平该反应的化学方程式,标出电子转移的数目和方向;
(5) 已知磷酸二氢钠(NaH2PO4)溶液中NaH2PO4是三元酸,分三步电离且电离程度越来越小,分别生成H2PO4﹣、HPO42﹣和PO43﹣。
(1)Si原子的电子排布式为1s22s22p63s23p2,最外层含有4个电子,4个电子的运动状态均不同,所以最外层有4种运动状态不同的电子,占据1个3s轨道和2个3p轨道,共占据3个轨道;
(2)Y 和Si 间只有一根共价键且在第三周期,则Y是Cl;X周围连接了2根共价键,又在第三周期,则X是S元素,S元素的电负性比Si元素大,则X和Si之间共用电子对偏离Si;
(3)SiCl4和CCl4分子空间结构相似,都是正四面体结构,SiCl4中键角是109°28′;SiCl4 和CCl4 是组成和结构相似的分子晶体,SiCl4 的相对分子质量大,分子间作用力强,故SiCl4 的熔点高;
(4)黄磷(P4)与过量浓NaOH溶液反应,产生PH3和次磷酸钠(NaH2PO2),P的化合价由0价下降到-3价,同时又从0价上升到+1价,P4既是氧化剂又是还原剂,还原产物PH3 和氧化产物NaH2PO2的系数比为1:3,该反应共转移电子3个,配平该反应的化学方程式,标出电子转移的数目和方向为:![]() ;其中氧化剂和还原剂质量比为1:3;H3PO2在水中只能电离出一个氢离子,故次磷酸是一元酸;
;其中氧化剂和还原剂质量比为1:3;H3PO2在水中只能电离出一个氢离子,故次磷酸是一元酸;
(5) 已知磷酸二氢钠(NaH2PO4)溶液中NaH2PO4是三元酸,分三步电离且电离程度越来越小,分别生成H2PO4﹣、HPO42﹣和PO43﹣,浓度关系为:c (H2PO4﹣) > c (HPO42﹣) > c (PO43﹣)。


科目:高中化学 来源: 题型:
【题目】将一定量的铁粉加入到一定浓度的稀硝酸中,金属恰好完全溶解,反应后溶液中存在:![]() ,则参加反应的Fe和HNO3的物质的量之比为( )
,则参加反应的Fe和HNO3的物质的量之比为( )
A.5∶16B.1∶1C.2∶3D.3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2007年诺贝尔化学奖授予埃特尔以表彰其对于合成氨反应机理的研究,氮气和氢气分子在催化剂表面的部分变化过程如图所示,下列说法不正确的是( )
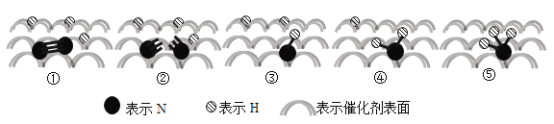
N2(g)+3H2(g)![]() 2NH3(g) △H = 92 kJ/mol
2NH3(g) △H = 92 kJ/mol
A.升高温度不能提高一段时间内NH3的产率
B.图①→②过程吸热,图②→③过程放热
C.N2在反应过程中三键均发生断裂
D.反应过程中存在NH、NH2等中间产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密闭容器中进行如下反应:X(g)+3Y(g)![]() 2Z(g),X、Y、Z起始浓度分别是0.2mo1/L、0.6mol/L、0.4mol/L,当达到平衡时,下列数据可能正确的是
2Z(g),X、Y、Z起始浓度分别是0.2mo1/L、0.6mol/L、0.4mol/L,当达到平衡时,下列数据可能正确的是
A. X为0.25mol/L,Z为0.5mol/L B. Y为1.2mo1/L
C. X为0.3mol/L,Z为0.3mol/L D. Z为0.6mo1/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与有机物的结构、性质的有关叙述中正确的是( )
A.等物质的量的乙烯与乙醇完全燃烧消耗氧气的物质的量相等
B.乙烯、氯乙烯、聚乙烯均可使酸性高锰酸钾溶液褪色
C.分馏、干馏都是物理变化,裂化、裂解都是化学变化
D.苯乙烯和甲苯分子内所有原子可能共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图装置探究NH3和CuSO4溶液的反应。
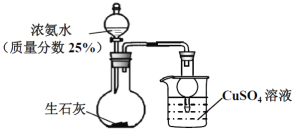
(1)上述制备NH3的实验中,烧瓶中反应涉及到多个平衡的移动:NH3+H2O![]() NH3H2O、____________、_________________(在列举其中的两个平衡,可写化学用语也可文字表述)。
NH3H2O、____________、_________________(在列举其中的两个平衡,可写化学用语也可文字表述)。
(2) 制备100mL25%氨水(ρ=0.905gcm-3),理论上需要标准状况下氨气______L(小数点后保留一位)。
(3) 上述实验开始后,烧杯内的溶液__________________________,而达到防止倒吸的目的。
(4)NH3通入CuSO4溶液中,产生蓝色沉淀,写出该反应的离子方程式。_______________________。继续通氨气至过量,沉淀消失得到深蓝色[Cu(NH3)4]2+溶液。发生如下反应:2NH4+(aq)+Cu(OH)2(s)+2NH3(aq)![]() [Cu(NH3)4]2+(aq)(铜氨溶液)+2H2O+Q(Q>0)。
[Cu(NH3)4]2+(aq)(铜氨溶液)+2H2O+Q(Q>0)。
①该反应平衡常数的表达式K=___________________________。
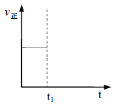
②t1时改变条件,一段时间后达到新平衡,此时反应K增大。在下图中画出该过程中v正的变化___________________。
③向上述铜氨溶液中加水稀释,出现蓝色沉淀。原因是:________________________________。
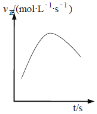
④在绝热密闭容器中,加入NH4+(aq)、Cu(OH)2和NH3(aq)进行上述反应,v正随时间的变化如下图所示,v正先增大后减小的原因__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化合物的结构(键线式)及球棍模型如下:
该有机分子的核磁共振氢谱图如下(单位是ppm):
![]()
化学位移5
下列关于该有机物的叙述正确的是
A. 该有机物属于芳香族化合物
B. 键线式中的Et代表的基团为-CH3
C. 该有机物不同化学环境的氢原子有8种
D. 该有机物在氢氧化钠醇溶液加热的情况下能发生消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为一种特殊的热激活电池示意图,当无水LiCl-KCl混合物受热熔融后即可工作。该电池总反应为:PbSO4(s)+2LiCl+Ca(s) = CaCl2(s)+Li2SO4+Pb(s)。下列说法不正确的是( )
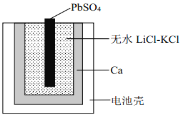
A.PbSO4电极发生还原反应
B.负极的电极反应:Ca + 2Cl--2e-=CaCl2
C.用LiCl和KCl水溶液代替无水LiCl-KCl,可将该电池改为常温使用的电池
D.放电时 Li+、 K+向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中,互为同分异构体的是 ( )
A. 与
与
B. 与CH3CH2CH2CH2Cl
与CH3CH2CH2CH2Cl
C.CH4与CH3CH3
D.CH3CH(CH3)CH2CH2CH3与CH3CH2CH2CH(CH3)CH3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com