
化学兴趣小组的同学用如图实验装置电解硫酸铜溶液,a、b为惰性电极。则下列说法错误的是
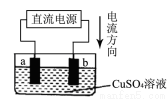
A.a是电解池的阴极、b是电解池的阳极
B.b电极上的电极反应为:4OH--4e-=2H2O + O2↑
C.通电一段时间后,溶液的PH减小
D.通电一段时间后,欲使电解液恢复到起始状态,应向溶液中加入适量的CuSO4
科目:高中化学 来源:2014-2015学年山西省高一上学期第一次考试化学试卷(解析版) 题型:选择题
过滤后的食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4等杂质,通过如下几个实验步骤,可制得纯净的食盐水:①加入稍过量的Na2CO3溶液;②加入稍过量的NaOH溶液;③加入稍过量的BaCl2 溶液;④滴入稀盐酸至无气泡产生;⑤过滤 正确的操作顺序( )
A.①②③⑤④ B.③②①⑤④
C.②③①④⑤ D.③⑤②①④
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山西大学附中第一学期高二化学试卷(解析版) 题型:填空题
下列共有十二种化学符号:
①O2 ②614C ③238U ④1123Na ⑤O3 ⑥714N ⑦1224Mg ⑧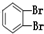
⑨235U ⑩ (11)
(11)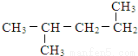 (12)
(12)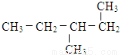
其中:
(1)表示核素的符号共有___种.
(2)互为同位素的是___(填序号,以下相同)
(3)质量数相等,但不能互称同位素的是__
(4)中子数相等,但质子数不相等的是___.
(5)互为同素异形体的是___.
(6)互为同分异构体的是___.
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山西大学附中第一学期高二化学试卷(解析版) 题型:选择题
决定化学反应速率的主要因素是
A、反应物的浓度 B、反应温度 C、使用催化剂 D、反应物的性质
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省潍坊三县市高二上学期联考化学试卷(解析版) 题型:填空题
(10分)硫酸是工业生产中最为重要的产品之一,也是化学工业的重要原料。
(1)在硫酸工业生产中,我国采用黄铁矿为原料(与氧气反应)生产SO2,进料前必须将黄铁矿粉碎,目的是________。
(2)实验测得SO2反应生成SO3的转化率与温度、压强有关,请根据下表信息,结合工业生产实际,选择最合适的生产条件是 。
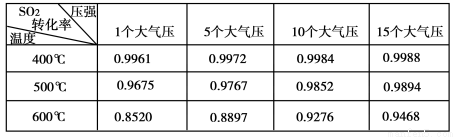
(3)利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。
已知在T2温度时:2SO2(g)+O2(g) 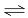 2SO3(g);△H=-196.6kJ·mol-1,
2SO3(g);△H=-196.6kJ·mol-1,
①在T1温度时,该反应的平衡常数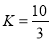 ,若在此温度下,向10L的恒容密闭容器中,充入0.3 mol SO2(g)、1.6mol O2(g) 和0.3 mol SO3(g),则反应开始时正反应速率 逆反应速率(填“<”、“>”或“=”)。
,若在此温度下,向10L的恒容密闭容器中,充入0.3 mol SO2(g)、1.6mol O2(g) 和0.3 mol SO3(g),则反应开始时正反应速率 逆反应速率(填“<”、“>”或“=”)。
②在T2温度时,开始在10L的密闭容器中加入4. 0 mol SO2(g)和10mol O2(g),一定条件下当反应达到平衡时共放出热量196.6kJ。此时二氧化硫的转化率为 。
③在②中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原减小的是 (填字母)。
A.保持温度和容器体积不变,充入1mol O2(g)
B.保持温度和容器体积不变,充入2mol SO3 (g)
C.降低温度
D.在其他条件不变时,减小容器的容积
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省潍坊三县市高二上学期联考化学试卷(解析版) 题型:选择题
常温下,下列各组离子在有一定关限定条件下的溶液中一定能大量共存的是
A.由水电离产生的c(H+)=10-12 mol·L一1的溶液中:K+、Na+、Fe2+、NO3-
B.常温下,pH=7的溶液中: Al3+、Cl-、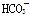 、SO42-
、SO42-
C.常温下,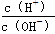 =1×10-12的溶液:K+、Cu2+、S2-、Cl-
=1×10-12的溶液:K+、Cu2+、S2-、Cl-
D.pH=13的溶液中:K+、Ba2+ 、Cl-、OH-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省潍坊三县市高一上学期联考化学试卷(解析版) 题型:填空题
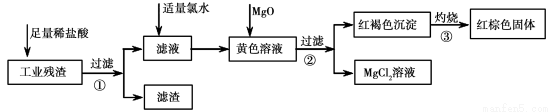
(12分)某工业残渣主要成分为Fe2O3。(含有少量FeO、Cu、Mg等杂质)某课外兴趣小组利用该残渣制取Fe2O3粉末的实验流程如下:(说明流程中向黄色溶液中加入MgO的目的是调节溶液的酸碱性,使Fe3+ 生成沉淀而Mg2+不沉淀。)
请回答下列问题:
(1)加入足量稀盐酸后,发生化学反应的类型有_____________(填写代号)。
A.置换反应 B.化合反应 C.分解反应 D.复分解反应 E.氧化还原反应
(2)加入适量氯水的作用是 ;
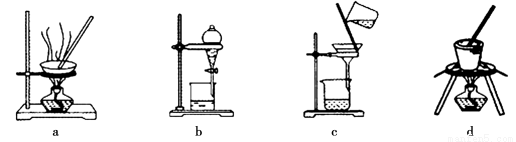
(3)写出灼烧红褐色沉淀时发生反应的化学方程式 。实验室灼烧红褐色沉淀可选用的装置是__________(填序号)。
(4)若向黄色溶液中加入过滤①后的滤渣发生反应的离子方程式为 。
(5)检验黄色溶液中Fe3+是否完全沉淀的方法是:取过滤②后的少量滤液于试管中, 。(请补充完整实验操作、现象、结论)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省潍坊三县市高一上学期联考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.非金属氧化物一定为酸性氧化物
B.化合反应一定有单质参加反应
C.向煮沸的1 mol·L-1 NaOH溶液中滴加FeCl3饱和溶液制备Fe(OH)3胶体
D.医疗上的血液透析利用了胶体的性质
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省乐陵市高二上学期期中考试化学试卷(解析版) 题型:选择题
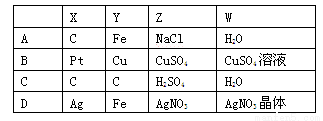
用阳极X和阴极Y电解Z的水溶液,电解一段时间后,再加入W,能使溶液恢复到电解前的状态,符合题意的一组是
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com