
����Ŀ��ij��ѧС��ģ�⡰�����Ƽ������NaCl��NH3��CO2��ˮ��Ϊԭ���Լ���ͼ��ʾװ����ȡNaHCO3����Ӧ�Ļ�ѧ����ʽΪNH3+CO2+H2O+NaCl = NaHCO3��+NH4Cl��Ȼ���ٽ�NaHCO3�Ƴ�Na2CO3��
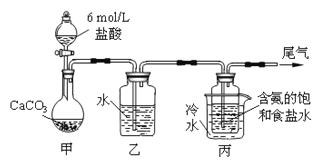
��װ���ҵ�������__________��Ϊ��ֹ��Ⱦ������β���к��е�_____��Ҫ�������մ�����
����װ�ñ��в�����NaHCO3��ȡNa2CO3ʱ����Ҫ���е�ʵ�������__________��NaHCO3ת��ΪNa2CO3�Ļ�ѧ����ʽΪ___________��
�����ڢ������յ�ʱ��϶̣�NaHCO3���ֽⲻ��ȫ����С���һ�ݼ�����t1min��NaHCO3��Ʒ����ɽ���������̽����
ȡ������t1min��NaHCO3��Ʒ29.6 g��ȫ����ˮ�Ƴ���Һ��Ȼ�������Һ�л����صμ�ϡ���ᣬ�����Ͻ��衣��������ļ��룬��Һ���й����ӵ����ʵ����ı仯����ͼ��ʾ��
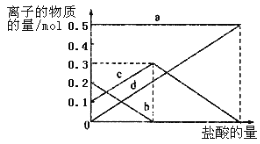
������c��Ӧ����Һ�е�������______�������ӷ��ţ�������Ʒ��NaHCO3��Na2CO3�����ʵ���֮����_____��
����ȡ21.0 g NaHCO3���壬������t2min��ʣ����������Ϊl4.8 g������Ѵ�ʣ�����ȫ�����뵽200 mL 2 mol��L-1�����������ַ�Ӧ����Һ��H+�����ʵ���Ũ��Ϊ_________������Һ����仯���Բ��ƣ���
���𰸡���1����ȥ������̼�е��Ȼ������壨2�֣� ���� ��1�֣�
��2�����ˡ�ϴ�ӡ����� ����1�֣� 2NaHCO3![]() Na2CO3+H2O+CO2����2�֣�
Na2CO3+H2O+CO2����2�֣�
��3��HCO3����2�֣� 1:2 ��2�֣� ��4�� 0.75 mol/L��2�֣�
�������������������1��װ�ü����Ʊ�������̼����ķ�Ӧװ�ã����ɵĶ�����̼�����к����Ȼ������壬���Ʊ�̼��������Ӱ�죬װ���ҵ������������Ȼ������壻����β���к��а��������ŷŵ������У���Ҫ����β�����գ��ʴ�Ϊ������HCl��NH3����2����װ�ñ��в�����NaHCO3�����ķ�ӦΪ��NH3+CO2+H2O+NaCl=NaHCO3��+NH4Cl����ȡNa2CO3ʱ��Ҫ���˵õ����壬ϴ�Ӻ�������յõ�̼���ƣ��ʴ�Ϊ�����ˡ�ϴ�ӡ����գ���3�����ڣ�2�������յ�ʱ��϶̣�NaHCO3���ֽⲻ��ȫ����С���һ�ݼ�����t1min��NaHCO3��Ʒ����ɽ������о���ȡ������t1min��NaHCO3��Ʒ29.6g ��ȫ����ˮ�Ƴ���Һ��Ȼ�������Һ�л����صμ�ϡ���ᣬ�����Ͻ��裮��������ļ��룬������Ӧ CO32-+H+=HCO3-�� HCO3-+H+=CO2��+H2O����Һ���й����ӵ����ʵ����ı仯Ϊ̼������Ӽ�С��̼���������Ũ������̼�������ȫ��ת��Ϊ̼��������ӣ��ٵ��������̼��������ӷ�Ӧ���ɶ�����̼��̼��������Ӽ�С������c���߱�ʾ����̼���������Ũ�ȱ仯��̼�������Ũ��0.2mol/L��̼���������Ũ��Ϊ0.1mol/L����Ʒ��NaHCO3��Na2CO3�����ʵ���֮����1��2���ʴ�Ϊ��HCO3-�� 1��2����4����ȡ21g NaHCO3�������ʵ���Ϊ0.25mol ��������t2min��ʣ����������Ϊ14.8g�����ݻ�ѧ����ʽ���ڵ������仯���㣺 2NaHCO3=Na2CO3+CO2��+H2O��m
2 1 62
0.2mol 0.1mol 21g-14.8g
��Ӧ��NaHCO3���ʵ���=0.25mol-0.2mol=0.05mol��NaHCO3+HCl=NaCl+H2O+CO2���������Ȼ������ʵ���0.05mol�� Na2CO3���ʵ���=0.1mol��Na2CO3+2HCl=2NaCl+H2O+CO2���������Ȼ������ʵ���0.2mol��ʣ���Ȼ������ʵ���=0.200L��2mol/L-0.05mol-0.2mol=0.15mol��ʣ����Һ��c��H+��=0.75mol/L



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A������һ��ǿ��ԭ�������Խ��ѡ�������������Ȼ�����Һ���û�����
B��ͭ�����Ȼ�����Һ��Ӧ���÷�Ӧ����Ӧ����ӡˢ��·�������
C�����Ƿ�����118��Ԫ�أ�������118�ֺ���
D��H2��D2��Ϊͬλ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͬһ�����£�����˳���ϵ����ȷ����
A. ��ˮ�е��ܽ�ȣ��Ҷ���>������
B. ��Һ��pH��̼������>������
C. �е㣺CH3OH>HCHO
D. ���Ʒ�Ӧ�Ŀ�����ˮ>�Ҵ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʯ����Ҫ�ɷ�ΪFeS2������FeS���������������в���Fe��SԪ�أ��Ҹ����²�������ѧ�仯�������ҹ���������᳧��ȡ�������Ҫԭ�ϡ�ij��ѧ��ȤС��Ըû�����ʯ��������ʵ��̽������m 1 g�û�����ʯ����Ʒ��������ͼװ�ã��гֺͼ���װ���ԣ���ʯӢ���У���a�����ϵػ���ͨ��������������ջ�������Ʒ����Ӧ��ȫ���䷴Ӧ�Ļ�ѧ����ʽΪ��
4FeS2+11O2![]() 2Fe2O3+8SO2 4FeS+7O2
2Fe2O3+8SO2 4FeS+7O2![]() 2Fe2O3+4SO2
2Fe2O3+4SO2
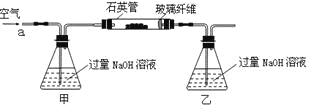
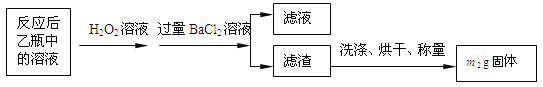
��ʵ��һ�����ⶨ��Ԫ�صĺ�����Ӧ��������ƿ�е���Һ�������´�����
��1�����������������__________________________________________��
��2����Ӧ��������ƿ�е���Һ�������H2O2��Һ��Ŀ����_______________���û�ѧ����ʽ��ʾ����
H2O2���Կ�����һ�ֺ������ᣬд������뷽��ʽ�� ��
��3���û�����ʯ����Ԫ�ص���������Ϊ__________���г�����ʽ���ɣ���
��ʵ��������ⶨ��Ԫ�صĺ���
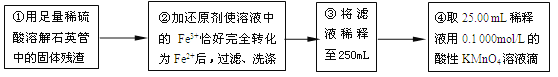
��4�����У�������������ԭ����������õ���Ԫ�صĺ���_______������ƫ��������ƫС��������Ӱ��������
��5�����У���Ҫ�õ����������ձ�������������ͷ�ι��⣬����_______��
��6��ijͬѧһ���������Ĵεζ�ʵ�飬ʵ������¼���£�
ʵ����� | ��һ�� | �ڶ��� | ������ | ���Ĵ� |
����KMnO4��Һ���/mL | 25.00 | 25.03 | 20.00 | 24.97 |
�����������ݣ������ϡ��Һ��Fe2+�����ʵ���Ũ��Ϊc(Fe2+) ��___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ֶ���������Ԫ��X��Y��Z��W��R��X��ԭ�Ӱ뾶�Ƕ���������Ԫ�������ģ�YԪ�� ��ԭ������������Ϊm������������Ϊn��ZԪ�ص�ԭ��L�������Ϊm+n��M�������Ϊm-n��WԪ����ZԪ��ͬ���壬RԪ����YԪ��ͬ���塣���������������
A. 60gZY2�к���2molZ-Y���Թ��ۼ�
B. Y���⻯���R���⻯���ȶ����۷е��
C. Z��W��R����������Ӧˮ���������ǿ��˳���ǣ�R>W>Z
D. X��Y�γɵ����ֳ��������������������ӵĸ����Ⱦ�Ϊ1��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���X�ķ���ʽΪC5H11Cl����NaOH�Ĵ���Һ����X���ɵõ�����ʽΪC5H10�����ֲ���Y��Z��Y��Z��������ɵõ�2�����顣��X�Ľṹ��ʽ����Ϊ(����)
A. ![]() B.
B. 
C.  D.
D. 
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ԫ�أ�a��b��c��d��ԭ������������������Ԫ���γɵĵ�������Ϊm��n��p��q��x��y��z����ЩԪ����ɵĶ�Ԫ���������zΪ�γ��������Ҫ����֮һ��25��0.01mol��L-1w��Һ�У�![]() ���������ʵ�ת����ϵ��ͼ��ʾ������˵����ȷ����( )
���������ʵ�ת����ϵ��ͼ��ʾ������˵����ȷ����( )

A. ԭ�Ӱ뾶�Ĵ�С��a<b<c<d B. �⻯��ķе㣺b>d
C. x�ĵ���ʽΪ��![]() D. y��w���еĻ�ѧ��������ȫ��ͬ
D. y��w���еĻ�ѧ��������ȫ��ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���0.10mol��L-1��NaOH��Һ�ֱ�ζ������Ϊ50.00mL��Ũ�Ⱦ�Ϊ0.05mol��L-1��HClO��HF������Һ����ζ�������ͼ��ʾ��

����˵����ȷ����
A. HClO�����Ա�HFǿ
B. V(NaOH��Һ)=0 mL ʱ����Ӧ��Һ�У�c(ClO-)=c(F-)
C. V(NaOH��Һ)=12.50 mL ʱ����Ӧ��Һ�У�c(ClO-)>c(F-)
D. V(NaOH��Һ)=25.00mLʱ����Ӧ��Һ�У�c(ClO-)<c(F-)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com