
【题目】设NA为阿伏加德罗常数,下列叙述中正确的是( )
A.标准状况下,11.2L苯中含有C﹣H键的数目为3NA
B.常温下,1.0LpH=13的Ba(OH)2溶液中含有的OH﹣数目为0.1NA
C.常温下,56g铁片投入足量浓H2SO4中生成NA个SO2分子
D.电解饱和食盐水,阳极产生22.4L气体时,电路中通过的电子数目为2NA
科目:高中化学 来源: 题型:
【题目】[Cu(NH3)4]SO4·H2O是一种重要的染料及合成农药中间体,受热可分解。某化学课外小组设计了如下实验(部分夹持装置略)验证它的部分分解产物,请回答问题:
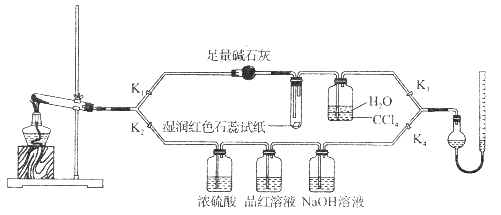
(1)连接装置,_________________________,在各装置中加入相应的药品和试剂。
(2)打开K2、K4,闭合K1、K3,加热一段时间后观察到品红溶液褪色,写出NaOH溶液中发生反应的离子方程式_____________________。
(3)打开K1、K3,闭合K2、K4,继续加热一段时间后观察到湿润红色石蕊试纸变蓝,证明分解产物中含有________________(填化学式)。
(4)CCl4的作用是__________________。
(5)加热过程中,还生成Cu、N2和H2O。写出[Cu(NH3)4]SO4·H2O分解的化学方程式________________。
(6)若实验中称取a g [Cu(NH3)4]SO4 · H2O,收集到b mL N2(已换算成标准状况),[Cu(NH3)4]SO4·H2O的分解率表达式为_______________。
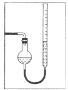
(7)量气管读数时需注意的事项有:①气体冷却到室温;②量气装置两侧液面相平;③______________。若某同学按右图所示读数,则计算出的分解率_______________(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)把NaHCO3和Na2CO3·10H2O混合物6.56g溶于水制成100ml溶液,测得溶液中c(Na+)=0.5mol/L。
向该溶液中加入盐酸至不再产生气体为止,将溶液蒸干后,所得固体质量为___________。
(2)将24.0g氢氧化钠固体放入水中,要使100个水分子中就含有一个Na+离子,所需水的质量为_________________。
(3)现有HNO3和NaNO3的混合溶液200mL,其中 HNO3和NaNO3的物质的量浓度均为1mol/L.若要使 HNO3和NaNO3 的物质的量浓度分别为2mol/L 和0.2mol/L,则须加入63%的浓硝酸(密度为1.2g/cm3)___________mL,再加入蒸馏水稀释至_______毫升才能实现。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量浓度相同的三种钠盐NaX、NaY、NaZ的溶液,其pH依次为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是
A. HX、HZ、HY B. HZ、HY、HX
C. HX、HY、HZ D. HY、HZ、HX
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在花瓶中加入“鲜花保鲜剂”,能延长鲜花的寿命。下表是1 L“鲜花保鲜剂”中含有的成分,阅读后回答下列问题:
成分 | 质量(g) | 摩尔质量(g ·mol-1) |
蔗糖 | 50.00 | 342 |
硫酸钾 | 0.50 | 174 |
阿司匹林 | 0.35 | 180 |
高锰酸钾 | 0.50 | 158 |
硝酸银 | 0.04 | 170 |
⑴下列“鲜花保鲜剂”的成分中,属于非电解质的是 。
A、蔗糖 B、硫酸钾 C、高锰酸钾 D、硝酸银
⑵“鲜花保鲜剂”中K+(阿司匹林中不含K+)的物质的量浓度为 mol.L-1。(只要求写表达式,不需要计算)
⑶配制上述1 L“鲜花保鲜剂”所需的仪器有:烧杯、玻璃棒、药匙、 、 、 。(在横线上填写所缺仪器的名称)
⑷在溶液配制过程中,下列操作正确且对配制结果没有影响的是 。
A.将药品放入容量瓶中加蒸馏水溶解
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨氧燃料电池具有很大的发展潜力,其工作原理如图所示。下列有关该电池的说法错误的是
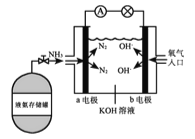
A.该电池工作时,溶液的pH不变
B.a电极为负极,b电极为正极
C.电子从a电极流出,经过导线到达b电极
D.电池总反应为4NH3+3O2=2N2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将5.60 g铁投入100 mL某浓度的盐酸中,铁和盐酸恰好完全反应。
求:(1)5.60 g铁的物质的量
(2)所用盐酸中HCl中的物质的量浓度
(3)反应中生成的H2在标准状况下的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质性质与应用对应关系正确的是( )
A. KAl(SO4)2 12H2O能水解生成Al(OH)3胶体,可用作净水剂
B. SO2有漂白、杀菌性能,可在食品加工中大量使用
C. MnO2有较强的氧化性,可作H2O2分解的氧化剂
D. Si是半导体材料,可用于制光导纤维
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨、烧碱在工农业生产和工业废水处理中具有广泛用途。回答下列问题:
(1)工业上制取硝酸的第一步是以氨和空气为原料,用铂一铑合金网为催化剂,在氧化炉中(温度为800℃)进行氨催化氧化反应。该反应的氧化产物为____________(填名称)。
(2)某工业废水中含有2Mg2+、Cu2+等离子。取一定量的该工业废水,向其中滴加烧碱溶液,当Mg(OH)2开始沉淀时,溶液中![]() 为____________。已知Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20
为____________。已知Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20
(3)已知反应N2(g)+3H2(g)![]() 2NH3(g)的△H=-92.2kJ/mol,1molN2(g),1molH2(g)分子中化学键断裂时分别需要吸收944.6KJ、436KJ的能量,则1molNH3(g)分子中化学键断裂时需吸收的能量为__________KJ。
2NH3(g)的△H=-92.2kJ/mol,1molN2(g),1molH2(g)分子中化学键断裂时分别需要吸收944.6KJ、436KJ的能量,则1molNH3(g)分子中化学键断裂时需吸收的能量为__________KJ。
(4)Fritz Haber 研究了下列反应:N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
在500℃、20MPa时,将N2和H2通入到体积为2L的密闭容器中,反应过程中各种物质的物质的量变化如右图所示:

①在0~10min内,平均反应速率v(NH3)= ___________。
②在10~20min内,各物质浓度变化的原因可能是_________(填“加了催化剂”或“降低温度”),其判断理由是________________。
③温度和密闭容器的容积一定时,当容器内的总压强不再随时间而变化,反应是否达到了化学平衡状态?___________(填“是”或“否”)其判断理由是_________________。
④500℃时,该反应的平衡常数K的计算式为_________(不需要算出结果,) NH3的体积分数是_________(保留两位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com