
海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架、泥三角外,还需要用到的实验仪器是
A.烧杯 B.表面皿 C.坩埚 D.酒精灯 E.圆底烧瓶
(2)请写出步骤④中反应的离子方程式:
(3)步骤⑥是从含碘的苯溶液中分离出单质碘和回收苯,还需经过蒸馏,指出并改正下列实验装置中的错误之处(至少两处)。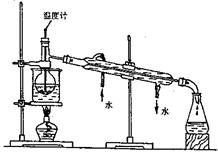
①
②
(4)步骤⑤中,某学生选择用苯来提取碘,其验操作可分解为如下几步:
(A)把盛有溶液的分液漏斗放在铁架台的铁圈中;
(B)把50毫升碘水和15毫升苯加入分液漏斗中,并盖好玻璃塞;
(C)检验分液漏斗活塞和上口的玻璃塞是否漏液;
(D)倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
(E)旋开活塞,用烧杯接收溶液;
(F)将分液漏斗上口倒出上层溶液;
(G)将漏斗上口的玻璃塞打开或使塞上的凹槽或小孔对准漏斗口上的小孔;
(H)静置,分层。就此实验,完成下列填空:
①正确操作步骤的顺序是 → → →A→G→ →E→F
②上述(G)步骤操作的目的是
③能选用苯从碘水中萃取碘的原因是
(1)C D(2分) (2)2I—+Cl2=I2+2Cl_(2分)
(3)①温度计水银球位置没有放在蒸馏烧瓶的支管口。正确做法应将温度计水银球的上限与蒸馏烧瓶支管口的下限对齐。
②冷凝管中的水流方向错误。正确做法应是上进下出
③烧杯不能直接加热。正确做法应该垫上石棉网(任写两处,共4分)
(4)① C → B → D →A→G→ H →E→F(2分)
②与大气相通,使液体顺利流下(2分)
③苯与水互不相溶且不反应;I2在苯中溶解度比在水中的大;苯与碘互不反应。(2分,漏写一点给扣1分,错写或漏写两点以上不给分)
解析试题分析:(1)灼烧是在高温下进行的,因此选用坩埚来作反应的容器。除了坩埚,还得选用酒精灯。 (2)步骤④是用氯气将溶液中的碘离子置换成碘单质:2I—+Cl2=I2+2Cl-(2分)
(3)①若像装置中这样插入液体中,测的是反应液的温度,温度计水银球位置没有放在蒸馏烧瓶的支管口。正确做法应将温度计水银球的上限与蒸馏烧瓶支管口的下限对齐。。
②为保证冷凝效果,冷凝管中的水流方向错误。正确做法应是上进下出,。
③为防止炸裂烧杯,烧杯不能直接加热。正确做法应该垫上石棉网,。
(4)① C → B → D →A→G→ H →E→F(2分)
②与大气相通,使液体顺利流下(2分)
③苯与水互不相溶且不反应;I2在苯中溶解度比在水中的大;苯与碘互不反应
考点:从海带中提取碘的有关知识。


科目:高中化学 来源: 题型:实验题
用纯碱和双氧水混合可制作新型液体洗涤剂(2Na2CO3·3H2O2),它具有杀菌消毒去油污的能力且不会污染水源。
(1)检验这种新型洗涤剂中金属阳离子的操作和现象是_______________________________________。
(2)这种洗涤剂中的双氧水可以将废水中的氰化物转化为无毒物同时生成NH3,写出反应的离子方程式:___________________________________
(3)如果配制洗涤剂的水中含有铁离子,不仅会削弱洗涤剂的去污能力,甚至完全失去杀菌作用。试分析其中的原因(用离子方程式和简要文字表述):__________________________________________________________________
(4)某化学学习小组为定性探究铁离子对这种新型洗涤剂的不良影响,取该洗涤剂100 mL,加入25 gFeCl3固体,产生大量无色无味气体,用贮气瓶收集气体。请选用下列试剂和实验用品完成气体成分的探究过程:0.10 mol·L-1 NaOH溶液、8.0 mol·L-1 NaOH溶液、澄清石灰水、0.01 mol·L-1 KMnO4溶液、BaCl2稀溶液、品红溶液、蒸馏水、小木条、酒精灯、火柴、洗气瓶。
①提出假设:对该气体成分提出合理假设。
假设1:气体是O2;
假设2:气体是________________;
假设3:气体是CO2。
②设计方案:设计实验方案证明你的假设,在下表中完成实验步骤、预期现象与结论。
| 实验步骤 | 预期现象与结论 |
| 将气体依次通入盛有________、________的洗气瓶中,________ | __________________ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某小组设计如图装置(部分夹持装置已略去),以探究潮湿的Cl2与Na2CO3反应得到固体物质的成分。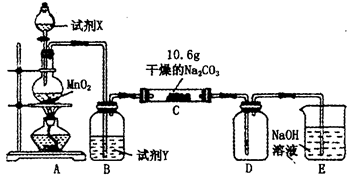
(1)A中制取Cl2的离子方程式_______________________________________.
(2)通入一定量潮湿的Cl2反应后,经检测,D中只有Cl2O一种气体,C中只含一种氯盐外,同时含有NaHCO3等,某同学对C中所得固体残渣的成分进行探究。
①提出合理假设。
假设1:存在两种成分:NaHCO3和_____________________________;
假设2:存在三种成分:NaHCO3和_____________________________。
②设计方案,进行实验。写出实验步骤以及预期现象和结论。
限选实验试剂和仪器:蒸馏水、稀HNO3、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。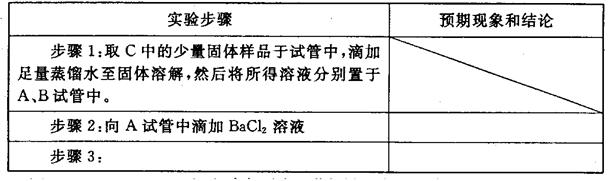
(3)已知C中有0.1 mol Cl2参加反应。若假设一成立,可推知C中反应的化学方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
现有含有少量NaCl、Na2SO4、Na2CO3等杂质的NaNO3溶液,选择适当的试剂除去杂质,得到纯净的NaNO3固体,实验流程如下图所示。
(1)沉淀A的主要成分是 、 (填化学式)。
(2)②中反应的离子方程式是 。
(3)①②③中均进行的分离操作是 。
(4)③中加入过量的Na2CO3溶液的目的是 。
(5)溶液3经过处理可以得到NaNO3固体,溶液3中肯定含有的杂质是 ,为了除去杂质,可向溶液3中加入适量的 。
(6)实验室用上述实验获得的NaNO3固体配制500 mL 0.40 mol/L NaNO3溶液。
①配制溶液时,进行如下操作:a.定容;b.计算;c.溶解;d.摇匀;e.转移;f.洗涤;j.称量。称取NaNO3固体的质量是 g。按照操作顺序,第4步是 (填序号)。
②某同学转移溶液的操作如图所示,图中仪器的名称是烧杯和 ,该同学操作中的错误是 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
Ⅰ某化学活动小组设计如下图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与干燥Na2CO3 固体反应得到的固体物质的成分。
已知:通入一定量的氯气后,测得D中只有一种常温下为黄红色的气体,其为含氯氧化物。可以确定的是C中固体含有NaHCO3 ,且含氯的盐只有一种。现对C的成分进行猜想和探究。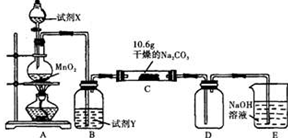
(1)提出合理猜想:若已知C中有0.1molCl2恰好和10.6克Na2CO3固体完全反应。则C中有Cl2参与反应的化学方程式可能 。
(2)①提出合理假设。
假设1:存在两种成分:NaHCO3和 ;
假设2:存在三种成分:NaHCO3和 、 。
②设计合理方案对C固体中的未知成分进行探究。请写出实验步骤以及预期现象和结论(可不填满)。
限选实验试剂和仪器:蒸馏水、稀HNO3、Ba(OH)2溶液、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量C中固体样品于试管中,加入足量蒸馏水,充分振荡至固体完全溶解,然后将所得溶液分装A、B两支试管中。 | |
| 步骤2: | |
| 步骤3: | |
| | |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
| | 苯 | 溴 | 溴苯 |
| 密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下: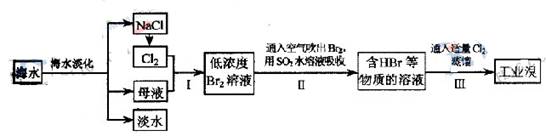
(1)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br?,其目的为 。
(2)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为 ,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是 。
(3)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃。微溶于水,有毒性和强腐蚀性。他们参观生产过程后,了如下装置简图: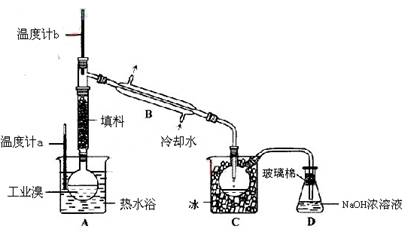
请你参与分析讨论:
①图中仪器B的名称 。
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是 。
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件: 。
④C中液体产生颜色为 。为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某化学兴趣小组的同学通过以下步骤提取海带中的碘:
①将海带晒干灼烧成灰 ②将海带灰浸泡得其悬浊液 ③过滤得含碘离子的溶液 ④向该溶液中加入适量Cl2置换出碘 ⑤对含碘溶液进行一系列的提取后得碘单质
(1)灼烧过程可在下列那种仪器中进行_____________
| A.烧杯 | B.试管 | C.蒸发皿 | D.坩埚 |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体和白色不溶物。某同学设计了如下实验方案并验证产物、探究反应原理。
(1)提出假设
实验I:用砂纸擦去镁条表面氧化膜,将其放入盛有适量滴有酚酞的饱和碳酸氢钠溶液的试管中,迅速反应,产生大量气泡和白色不溶物,溶液由浅红变红。
该同学对反应中产生的白色不溶物做出如下猜测:
猜测1:白色不溶物可能为 。
猜测2:白色不溶物可能为MgCO3。
猜测3:白色不溶物可能是碱式碳酸镁[xMgCO3·yMg(OH)2]。
(2)设计定性实验确定产物并验证猜测:
| 实验序号 | 实验 | 实验现象 | 结论 |
| 实验Ⅱ | 将实验I中收集到的气体点燃 | 能安静燃烧、产生淡蓝色火焰 | 气体成分为___?___ |
| 实验Ⅲ | 取实验I中的白色不溶物,洗涤,加入足量 ? | ? | 白色不溶物可能含有MgCO3 |
| 实验Ⅳ | 取实验I中的澄清液,向其中加入少量CaCl2稀溶液 | 产生白色沉淀 | 溶液中存在 ④ 离子 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com