
【题目】向200mL FeBr2溶液中逐渐通入C12,其中n(Fe3+)、n(Br2)随通入n(Cl2)的变化如图所示,下列说法不正确的是( )
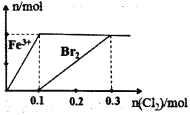
A.氧化性强弱:Br2>Fe3+
B.由图可知,该FeBr2溶液的浓度为1molL─1
C.n(Cl2)= 0.12 mol时,溶液中的离子浓度有c(Fe3+):c(Br-)=1:8
D.c(FeBr2):c(Br2)= 1: 1时,反应的离子方程式:2Fe3++2Br-+2Cl2=2Fe3++Br2+4Cl-
【答案】C
【解析】
A.由图可知,氯气先氧化亚铁离子,后氧化溴离子,则还原性:Fe2+<Br-,则氧化性强弱:Br2>Fe3+,故A正确;
B.图中通入0.1mol氯气时亚铁离子完全被氧化生成0.2molFe3+,由Fe原子守恒及c=![]() 可知该FeBr2溶液的浓度为
可知该FeBr2溶液的浓度为![]() =1molL1,故B正确;
=1molL1,故B正确;
C.n(Cl2)=0.12mol时,0.1mol氯气使亚铁离子完全被氧化生成0.2molFe3+,由2Br-+Cl2=2Cl-+Br2可知,0.02molCl2氧化0.04molBr-,溶液中的离子浓度有c(Fe3+):c(Br-)=0.2mol:(0.4mol-0.04mol)=5:9,故C错误;
D.n(FeBr2):n(Cl2)=1:1时,由电子守恒可知,亚铁离子全部被氧化,溴离子一半被氧化,则反应的离子方程式为2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl-,故D正确;
故选:C。


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:
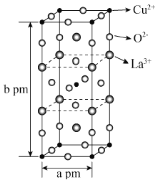
【题目】铜是人类利用最早的金属之一,其单质及化合物在人生产生活中有着广泛的应用。
(1)铜可以做成导线,Cu的焰色为___________色;基态Cu2+的核外电子占据的最高能层的能层符号为___________。
(2)铜可以作为乙醇和氧气反应的催化剂,2CH3CH2OH + O2![]() CH3CHO + 2H2O。写出与水具有相同空间构型的一个分子和一个离子______________(微粒由短周期元素组成)。从原子轨道重叠方式来看CH3CHO中所含的共价键类型有____________________,碳的杂化方式是______________。
CH3CHO + 2H2O。写出与水具有相同空间构型的一个分子和一个离子______________(微粒由短周期元素组成)。从原子轨道重叠方式来看CH3CHO中所含的共价键类型有____________________,碳的杂化方式是______________。
(3)高温超导是世界上最前沿的研究之一,如下图是第一个被发现的高温超导体氧化物的晶胞。该化合物的化学式为___________。与Cu2+紧邻的O2-的个数为___________。已知,阿伏加德罗常数为NA,则晶胞密度为___________g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯与溴反应的实验装置如下图所示:
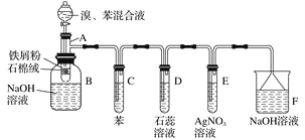
其中A为具有支管的试管改制成的反应容器,在其下端开了一个小孔,塞好石棉绒,再加入少量的铁屑粉。请回答下列问题:
(1)向反应容器A中逐滴加入溴和苯的混合液,几秒钟内就发生反应。写出A中发生反应的化学方程式(有机物写结构简式)___________________________________________________。
(2)试管C中苯的作用是__________________________________________________________。
(3)反应开始后,观察D和E两试管,看到的现象是__________________________________________________。
(4)反应2 min~3 min后,在B中的氢氧化钠溶液里可观察到的现象是___________________。
(5)在上述整套装置中,具有防倒吸作用的仪器有___________________________________。
(6)改进后的实验除①步骤简单,操作方便,成功率高;②各步现象明显;③对产品便于观察这三个优点外,还有一个优点是______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,正确的是 ( )
A. 稀硫酸滴在铁片上:2Fe+6H+===2Fe3++3H2↑
B. 碳酸氢钠溶液与稀盐酸混合:HCO3-+H+=H2O+CO2↑
C. 硫酸铜溶液与氢氧化钠溶液混合:CuSO4+2OH-===Cu(OH)2↓+![]()
D. 硝酸银溶液与氯化钠溶液混合:AgNO3+Cl-===AgCl↓+![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠![]() 是一种工业盐,外观与食盐相似。下面是某学习小组设计的
是一种工业盐,外观与食盐相似。下面是某学习小组设计的![]() 制取实验和纯度检验实验。该小组收集了相关资料:
制取实验和纯度检验实验。该小组收集了相关资料:
![]() 和
和![]() 溶液反应生成
溶液反应生成![]() 和
和![]() 为淡黄色接近白色固体,在水中形成沉淀
为淡黄色接近白色固体,在水中形成沉淀![]()
Ⅰ![]() 亚硝酸钠的制取实验
亚硝酸钠的制取实验
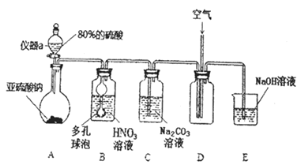
![]() 仪器a的名称为___________,A装置中发生的化学反应方程式为________________。
仪器a的名称为___________,A装置中发生的化学反应方程式为________________。
![]() 装置中多孔球泡的作用_________________________。
装置中多孔球泡的作用_________________________。
![]() 若装置B中逸出的NO与
若装置B中逸出的NO与![]() 气体物质的量之比为
气体物质的量之比为![]() ,则装置B中发生反应的化学方程式为_______。
,则装置B中发生反应的化学方程式为_______。
![]() 实验过程中需控制C装置中溶液
实验过程中需控制C装置中溶液![]() ,否则C中生成的
,否则C中生成的![]() 的产量会下降,理由是_______________。
的产量会下降,理由是_______________。
![]() 请根据题干所给信息设计实验证明C装置中有
请根据题干所给信息设计实验证明C装置中有![]() 产生:__________。
产生:__________。 ![]() 限选用的试剂:稀硝酸、硝酸银溶液、NaOH溶液
限选用的试剂:稀硝酸、硝酸银溶液、NaOH溶液![]()
Ⅱ![]() 亚硝酸钠的纯度检验
亚硝酸钠的纯度检验
已知:![]()
![]()
![]()
![]()
![]()
![]() 反应结束后C中溶液通过结晶获得
反应结束后C中溶液通过结晶获得![]() 粗产品mg,溶解后稀释至250mL,分别取
粗产品mg,溶解后稀释至250mL,分别取![]() 用
用![]() 的酸性
的酸性![]() 溶液平行滴定三次,平均每次消耗酸性
溶液平行滴定三次,平均每次消耗酸性![]() 溶液的体积为VmL。则粗产品中
溶液的体积为VmL。则粗产品中![]() 的质量分数为_______
的质量分数为_______![]() 用含c、V、m的式子表示
用含c、V、m的式子表示![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】污水处理厂处理含CN-废水的过程分两步进行:①向含CN-的废水中加入过量NaC1O将CN-转化为CNO-;②调节①所得溶液为酸性,使CNO-继续被NaC1O转化为两种无污染的气体。下列关于上述过程的叙述错误的是( )
A.CN-的电子式为![]()
B.过程①中,生成CNO-的反应中氧化剂与还原剂的物质的量之比为1:1
C.过程②中,生成的两种无污染的气体为CO2和N2
D.氧化性:CNO->C1O-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“重油—氧气—熔融碳酸钠”燃料电池装置如图所示。下列说法错误的是

A.O2在b极得电子,最终被还原为![]()
B.放电过程中,电子由电极a经导线流向电极b
C.该电池工作时,![]() 经“交换膜2”移向b极
经“交换膜2”移向b极
D.H2参与的电极反应为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为确定某铝热剂(含氧化铁和铝)的组成,分别进行下列实验。
(1)若取a g样品,向其中加入足量的氢氧化钠溶液,测得生成的气体(标准状况,下同)体积为b L,样品中铝的质量是______________g。
(2)若取a g样品将其点燃,恰好完全反应,该反应的化学方程式是:_______________________,氧化铁与铝的质量比是_____________。
(3)待(2)中反应产物冷却后,加入足量盐酸,测得生成的气体体积为c L,该气体与(1)中所得气体的体积比c:b__________。
(4)用铝热法还原下列物质,制得金属各1mol,消耗铝最少的是____________
A.MnO2 B.Fe3O4 C.Cr2O3 D. V2O5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池常用于航天飞船,由电极反应产生的水经冷凝后可作为航天员的饮用水,其电极反应如下:
负极:2H2+4OH--4e-=4H2O
正极:O2+2H2O+4e-=4OH-
当得到1.8 kg饮用水时,电池内转移电子的物质的量为
A.1.8 mol
B.3.6 mol
C.100 mol
D.200 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com