
| 化学键 | 断开1mol化学键所需的能量(kJ) |
| H-H | 436 |
| O-H | 463 |
| O=O | 498 |
| 实验编号 | 反应物 | 催化剂 | |
| a | 50mL 5% H2O2溶液 | 1mL 0.1mol?L-1 FeCl3溶液 | |
| b | 50mL 5% H2O2溶液 | 少量浓盐酸 | 1mL 0.1mol?L-1 FeCl3溶液 |
| c | 50mL 5% H2O2溶液 | 少量浓NaOH溶液 | 1mL 0.1mol?L-1 FeCl3溶液 |
| d | 50mL 5% H2O2溶液 | MnO2 | |

 ,故答案为:
,故答案为: ;
;| 1 |
| 2 |


 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:
| A、K+、Na+、CO32-、MnO4- |
| B、Na+、K+、Cl-、HCO3- |
| C、Na+、Cu2+、SO42-、NO3- |
| D、Ba2+、SO42-、NO3-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
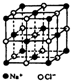 【化学--进修3:物质结构与性质】
【化学--进修3:物质结构与性质】查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 无机化合物可根据其组成和性质进行分类:
无机化合物可根据其组成和性质进行分类:| 物质类别 | 酸 | 碱 | 盐 | 氧化物 |
| 化学式 | HCl② |
③ |
⑤Na2CO3⑥ |
⑦CO2⑧Na2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸钙与醋酸反应 CO32-+2H+=CO2↑+H2O |
| B、硫酸钠和氯化钡溶液反应 Ba2++SO42-=BaSO4↓ |
| C、澄清石灰水中通入足量CO2:2OH-+CO2=CO32-+H2O |
| D、铁钉放入硫酸铜溶液中 2Fe+3 Cu2+=2 Fe3++3Cu |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com