
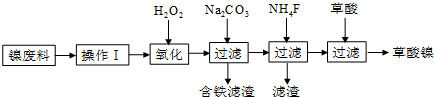
分析 流程分析,镍废料(镍、铁、钙、镁合金为主)制取草酸镍(NiC2O4•2H2O),在高温煅烧草酸镍制取三氧化二镍.镍废料加入酸溶解后过滤得到滤液中含有亚铁离子、钙离子、镁离子、镍离子,加入过氧化氢氧化亚铁离子为铁离子,加入碳酸钠溶液调节溶液的PH,使铁离子全部沉淀,过滤后的滤液在加入NH4F沉淀钙离子和镁离子,过滤得到溶液含有捏离子的溶液,在溶液中加入草酸生成草酸镍,蒸发浓缩结晶析出晶体为目标产物NiC2O4•2H2O,
(1)镍废料中主要是镍、铁、钙、镁合金为主,操作Ⅰ是酸溶后过滤,溶解金属,除去不溶物;
(2)过氧化氢氧化亚铁离子为铁离子,依据电荷守恒和原子守恒,加入Na2CO3溶液调pH至4.0〜4.5,促进铁离子水解形成氢氧化铁沉淀;
(3)草酸镍(NiC2O4•2H2O)在热空气中干燥脱水后生成NiC2O4,NiC2O4再发生氧化还原反应(Ni由+2价升高到+3价,则C由+3价降低到+2价,题中要求生成混合气体,则另一气体为CO2)生成Ni2O3、CO、CO2,再利用化合价升降相等配平;
(4)Cl由+1价降低到-1价,Ni由+2价升高到+3价,利用化合价升降相等可配平ClO-、Ni(OH)2、Cl-、Ni2O3的系数,再利用H原子守恒配平水的系数,最后可利用O原子检查配平是否正确;依据化学方程式和元素守恒计算得到;
(5)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,发生还原反应,则Al发生氧化反应,碱性条件下得到NaAlO2,配平书写方程式.
解答 解:(1)分析框图:“酸溶”生成含镍、铁、钙、镁离子的溶液,加酸溶解,溶解金属,除去不溶物过滤;
故答案为:加酸溶解,过滤;
(2)①加双氧水的目的是氧化生成Fe3+,反应的离子方程式为:2Fe2++H2O2+2H+═2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+═2Fe3++2H2O;
②加入碳酸钠溶液的作用是调节pH,促进铁离子水解沉淀完全,
故答案为:促进铁离子水解沉淀完全;
(3)草酸镍(NiC2O4•2H2O)在热空气中干燥脱水后生成NiC2O4,NiC2O4再发生氧化还原反应(Ni由+2价升高到+3价,则C由+3价降低到+2价,题中要求生成混合气体,则另一气体为CO2)生成Ni2O3、CO、CO2,再利用化合价升降相等,Ni:升高2×(3-2),C:升高1×(4-3),C:降低:3×(3-2),配平方程式为:2NiC2O4$\frac{\underline{\;高温\;}}{\;}$Ni2O3+3CO↑+CO2↑;
故答案为:2NiC2O4$\frac{\underline{\;高温\;}}{\;}$Ni2O3+3CO↑+CO2↑;
(4)Cl由+1价降低到-1价,Ni由+2价升高到+3价,利用化合价升降相等可配平ClO-、Ni(OH)2、Cl-、Ni2O3的系数,再利用H原子守恒配平水的系数,最后可利用O原子检查配平是否正确,得到离子方程式为:ClO-+2Ni(OH)2═Cl-+Ni2O3+2H2O;
ClO-+2Ni(OH)2═Cl-+Ni2O3+2H2O
1 2
n(ClO-) a mol
则n(ClO-)=0.5 a mol
Cl2+2OH-═ClO-+Cl-+H2O
0.8n(Cl2) 0.5 a mol
则n(Cl2)=0.625 a mol
进行电解时:
2Cl--2e-═Cl2↑
2 1
n(e-) 0.625 a mol
则n(e-)=1.25a mol;
故答案:ClO-+2Ni(OH)2═Cl-+Ni2O3+2H2O;1.25a mol;
(5)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,发生还原反应,则Al发生氧化反应,碱性条件下得到NaAlO2,该电池反应的化学方程式是:Al+3NiO(OH)+NaOH+H2O=3Ni(OH)2+NaAlO2,
故答案为:Al+3NiO(OH)+NaOH+H2O=3Ni(OH)2+NaAlO2.
点评 本题考查了流程分析推断,实验操作步骤的分析判断,化学方程式计算和电解原理分析应用,题目综合性较大,难度较大.


科目:高中化学 来源: 题型:选择题
| A. | 20:1 | B. | 1:20 | C. | 10:1 | D. | 1:10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| 选项 | 现象 | 结论 |
| A | ①中导管口冒气泡,手松开无现象 | 气密性良 |
| B | ②中KMnO4溶液紫红色褪去 | SO2具有漂白性 |
| C | ③中关闭K,气体颜色在热水中比冷水深 | NO2生成N2O4为吸热反应 |
| D | ④中烧瓶中形成喷泉 | Cl2易溶于CCl4 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在一定条件下,根据溶液导电性的变化,可以判断出电解质的强弱.已知溶液的导电性与溶液自由移动离子的浓度及其所带电荷有关.离子浓度越大,所带电荷越多,导电性就越强,如图是将KOH溶液分别加入到相同物质的量浓度的HCl溶液和CH3COOH溶液中的导电性变化情况.下列说法正确的是( )
在一定条件下,根据溶液导电性的变化,可以判断出电解质的强弱.已知溶液的导电性与溶液自由移动离子的浓度及其所带电荷有关.离子浓度越大,所带电荷越多,导电性就越强,如图是将KOH溶液分别加入到相同物质的量浓度的HCl溶液和CH3COOH溶液中的导电性变化情况.下列说法正确的是( )| A. | 虚线表示CH3COOH溶液,实线表示HCl溶液 | |
| B. | 由图可知,HCl溶液中加入KOH溶液后导电性将进一步增强 | |
| C. | 由图可知,加入KOH溶液到一定量后,导电性均会比原来强 | |
| D. | 若用NH3•H2O溶液加入到HCl溶液中,则导电性变化如图 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第2周期元素的第一电离能随原子序数递增依次增大 | |
| B. | 氟元素的电负性最大 | |
| C. | CO2、SO2都是直线形的非极性分子 | |
| D. | CH2═CH2分子中共有四个σ键和一个π键 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 同温同浓度Na2CO3和Na2SiO3水溶液的pH前者小于后者,则碳的非金属性强于硅 | |
| B. | 向淀粉溶液中加入稀硫酸,加热几分钟,冷却后加新制Cu(OH)2悬浊液,加热,无砖红色沉淀,则淀粉没有水解成葡萄糖 | |
| C. | 向无色溶液中加入氯水,再加CCl4,振荡静置后CCl4层呈紫色,则原溶液中含I- | |
| D. | 向某溶液中加入稀盐酸,产生的气体通入澄清石灰水,石灰水变浑浊,该溶液中一定含有CO32-或HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 混合物 | 试剂 | 分离方法 | |
| A | 苯(苯酚) | 溴水 | 过滤 |
| B | 甲烷(甲醛) | 水、浓硫酸 | 洗气 |
| C | 乙酸乙酯(乙酸) | 氢氧化钠溶液 | 蒸馏 |
| D | 淀粉胶体(氯化钠溶液) | 蒸馏水 | 萃取 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com