
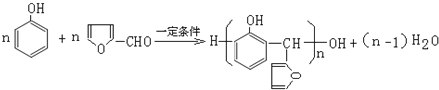
【题目】石油的裂解是石油化工的重要方法之王,石油的裂解产物是合成材料的重要的基础原料。例如工业上以丙烯为原料可制得一种重要合成橡胶IR和一种合成树脂X。

B的分子式是C6H6O,可与NaOH溶液反应。
已知以下信息:

(—R、—R’、—R’’表示可能相同或可能不同的原子或原子团。)
Ⅲ.同一碳原子上有两个碳碳双键时,分子不稳定。
请回答下列问题。
在一定条件下,丙烯可与下列物质反应的是__________。
A、H2O B、NaOH溶液 C、Br2的CCl4溶液 D、酸性KMnO4溶液
(2)A与C2H2合成D的化学方程式是___________________,反应类型是______________。
(3)E、F中均含有碳碳双键,则E的结构简式是_____________。
(4)H的结构简式是_____________。
(5)B与C在一定条件下反应生成合成树脂X的化学方程式是_____________。
(6)![]() 有多种同分异构体,符合下列要求的有___________种,其中在核磁共振氢谱中只出现四组峰的有_________种。
有多种同分异构体,符合下列要求的有___________种,其中在核磁共振氢谱中只出现四组峰的有_________种。
能与FeCl3溶液反应显紫色 ②只能发生银镜反应,不能发生水解反应
【答案】acd 加成反应
加成反应
![]()
 62
62
【解析】在催化剂条件下,丙烯和苯发生加成反应生成![]() ,
,![]() 发生氧化反应生成B和A,A和乙炔能发生反应生成D,根据题给信息及A的分子式知,A是丙酮,丙酮和乙炔发生加成反应生成D,则D的结构简式为
发生氧化反应生成B和A,A和乙炔能发生反应生成D,根据题给信息及A的分子式知,A是丙酮,丙酮和乙炔发生加成反应生成D,则D的结构简式为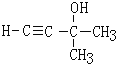 ,D和氢气发生加成反应生成E,E发生消去反应生成F,结合IR的结构简式知,F为CH2=CHC(CH3)=CH2,则E为
,D和氢气发生加成反应生成E,E发生消去反应生成F,结合IR的结构简式知,F为CH2=CHC(CH3)=CH2,则E为 .G和乙醛反应生成H,H和银氨溶液反应然后酸化生成
.G和乙醛反应生成H,H和银氨溶液反应然后酸化生成![]() ,所以H为
,所以H为![]() ,根据题给信息知,G的结构简式为:
,根据题给信息知,G的结构简式为:![]() ,B的分子式是C6H6O,可与NaOH溶液反应,B与G在一定条件下反应生成合成树脂X,所以B是苯酚,G和苯酚发生反应生成X,则X的结构简式为:
,B的分子式是C6H6O,可与NaOH溶液反应,B与G在一定条件下反应生成合成树脂X,所以B是苯酚,G和苯酚发生反应生成X,则X的结构简式为: ,
,
(1)丙烯含有碳碳双键,能与水、溴发生加成反应,能被酸性高锰酸钾氧化,不能与氢氧化钠发生反应,故选acd;
(2)A与C2H2合成D的化学方程式是: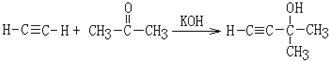 ,属于加成反应;
,属于加成反应;
(3)由上述分析可知,E的结构简式是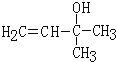 ;
;
(4)由上述分析可知,H的结构简式是![]() ;
;
(5)B与G在一定条件下反应生成合成树脂X的化学方程式是: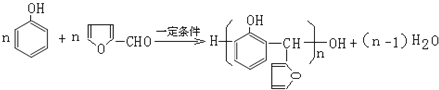 ;
;
(6)![]() 有多种同分异构体,符合下列要求的同分异构体:
有多种同分异构体,符合下列要求的同分异构体:
①能与FeCl3溶液反应显紫色,含有酚羟基;②只能发生银境反应,不能发生水解反应,含有醛基,故侧链为2个-OH、1个-CHO,当2个-OH相邻时、-CHO有2种位置,当2个-OH处于间位时、-CHO有3种位置,当2个-OH处于对位时、-CHO有1种位置,故共有2+3+1=6种,其中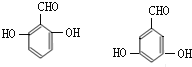 两种的核磁共振氢谱中只出现四组峰。
两种的核磁共振氢谱中只出现四组峰。


科目:高中化学 来源: 题型:
【题目】铜是重要的金属,广泛应用于电气、机械制造、国防等领域,铜的化合物在科学研究和工农业生产中有许多用途。回答下列问题:
(1)Cu原子的价层电子排布式为________。
(2)CuSO4晶体中S原子的杂化方式为________,SO![]() 的立体构型为________。
的立体构型为________。
(3)向CuSO4溶液中加入过量氨水,可生成[Cu(NH3)4]SO4,下列说法正确的是________。
a.氨气极易溶于水,是因为NH3分子和H2O分子之间形成3种不同的氢键
b.NH3分子和H2O分子,分子立体构型不同,氨气分子的键角小于水分子的键角
c.[Cu(NH3)4]SO4所含有的化学键有离子键、极性共价键和配位键
d.[Cu(NH3)4]SO4的组成元素中电负性最大的是氮元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A.SiO2和NO2能与强碱溶液反应,都是酸性氧化物
B.不锈钢材料因含有铬、镍所以抗腐蚀性好
C.普通玻璃、钢化玻璃、玻璃钢都属于硅酸盐产品,水玻璃可用于木材防腐
D.MgO和A12O3熔点较高都可以做耐火材料,都能和强碱溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,都是强电解质的是( )
A. HBr、HCl、BaSO4
B. NH4Cl、CH3COOH、Na2S
C. NaOH、Ca(OH)2、NH3·H2O
D. HClO、NaF、Ba(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)①根据图1所示,写出反应的热化学方程式______________________________。
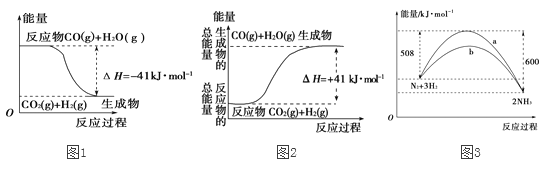
②根据图2所示情况,判断下列说法中正确的是 (____)
A.其热化学方程式为:CO(g)+H2O(g)===CO2(g)+H2(g) ΔH=+41kJ·mol-1
B.该反应为吸热反应
C.该反应为放热反应
D.当H2O为液态时,其反应热值小于41
(2)已知16 g固体硫完全燃烧时放出148.4 kJ的热量,该反应的热化学方程式是___________________。
(3)图3是某温度下,N2与H2反应过程中能量变化的曲线图。该反应的热化学方程式为:______________________________。a、b两条曲线分别代表生成由N2、H2合成氨的两个不同反应过程,其反应热△Ha ___△Hb(填“>”或“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过渡元素Ti、Mn、Fe、Cu等可与C、H、O形成多种化合物。请回答下列问题:
(1)根据元素原子的外围电子排布的特征,可将元素周期表分成五个区域,其中Mn属于________区。
(2)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。基态Ti2+中电子占据的最高能层符号为________,该能层具有的原子轨道数为________。BH![]() 的立体构型是________。
的立体构型是________。
(3)在Cu的催化作用下,乙醇可被空气中氧气氧化为乙醛,乙醛分子中碳原子的杂化方式是________,乙醛分子中HCO的键角________乙醇分子中HCO的键角(填“大于”、“等于”或“小于”)。
(4)电镀厂排放的废水中常含有剧毒的CN-,可在TiO2的催化下,先用NaClO将CN-氧化成CNO-,再在酸性条件下CNO-继续被NaClO氧化成N2和CO2。
①H、C、N、O四种元素的电负性由小到大的顺序为________________。
②与CN-互为等电子体微粒的化学式为________(写出一种即可)
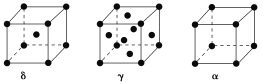
(5)单质铁有δ、γ、α三种同素异形体,三种晶胞中Fe原子的配位数之比为________,δ、γ、α三种晶胞的边长之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关反应原理的说法正确的是
A. 放热反应的反应速率总是大于吸热反应的反应速率
B. 化学反应速率越快可逆反应正向进行的程度越大
C. 纯银器表面在空气中因发生电化学腐蚀生成Ag2O而变暗
D. 应用盖斯定律可计算某些难以直接测量的反应的焓变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com