
已知:常温下,0.01 mol/L MOH溶液的pH为10,MOH(aq)与H2SO4(aq)反应生成1 mol正盐的ΔH=-24.2 kJ·mol-1,强酸与强碱的稀溶液的中和热为ΔH=-57.3 kJ·mol-1。则MOH在水溶液中电离的ΔH为( )
A.-69.4 kJ·mol-1 B.-45.2 kJ·mol-1
C.+69.4 kJ·mol-1 D.+45.2 kJ·mol-1
科目:高中化学 来源: 题型:
同周期主族元素,随原子序数递增,下列说法中错误的是
A.最外层电子数逐渐增多 B.元素最高正化合价均由+1递增到+7
C.原子半径逐渐减小 D.金属性逐渐减弱,非金属性逐渐增强
查看答案和解析>>
科目:高中化学 来源: 题型:
加强空气质量检测,客观分析空气中污染物的来源及性质,将有助于制定有针对性的治理措施。下表是某城市某日的空气质量报告:
| 污染指数 | 首要污染物 | 空气质量级别 | 空气质量状况 |
| 55 | SO2 | II | 良 |
该市某校研究性学习小组对表中首要污染物SO2导致酸雨的成因进行了如下探究:
(1)用下图所示装置进行实验。
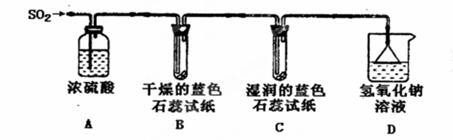
①A装置的作用是____________________。
②实验过程中,B装置内石蕊试纸的颜色没有发生变化,C装置内湿润的蓝色石蕊
试纸变成________________色,说明SO2与水反应生成一种酸,其化学反应方程式是 。
③D装置的作用是__________________________________________________,
D中发生反应的化学方程式是_________________________________________。
(2)往盛有水的烧杯中通入SO2气体,测得所得溶液的pH________7(填“>”“=”或“<”),然后每隔1h测定其pH,发现pH逐渐_______(填“变大”或“变小”), 直至恒定,原因是 (写出反应的离子方程式)。
(3)SO2形成酸雨的另一途径为:SO2与空气中的O2在飘尘的作用下反应生成SO3,SO3溶于降水生成H2SO4, 则在此过程中的飘尘是作为___________(填“催化剂”或“氧化剂”)。
(4)SO2与空气中的氧气、水反应生成硫酸而形成酸雨。该市可能易出现酸雨。
(5)汽车排放的尾气,硝酸、化肥等工业生产排出的废气中都含有氮的氧化物,氮的氧化物溶于水最终转化为__________________,是造成酸雨的另一主要原因。
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是ΔH=-393.5 kJ/mol、ΔH=-285.8 kJ/mol、ΔH=-890.3 kJ/mol、ΔH=-2 800 kJ/mol,则下列热化学方程式正确的是( )
A.C(s)+ O2(g)===CO(g)
O2(g)===CO(g)
ΔH=-393.5 kJ/mol
B.2H2(g)+O2(g)===2H2O(l)
ΔH=-571.6 kJ/mol
C.CH4(g)+2O2(g)===CO2(g)+2H2O(g)
ΔH=-890.3 kJ/mol
D. C6H12O6(s)+3O2(g)===3CO2(g)+3H2O(g)
C6H12O6(s)+3O2(g)===3CO2(g)+3H2O(g)
ΔH=-1 400 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
在元素周期表中,位于金属元素和非金属元素交界处最容易找到的材料是( )
A.制催化剂的材料 B.耐高温、耐腐蚀的合金材料
C.制农药的材料 D.半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
运用元素周期律分析下面的推断,其中错误的是( )
A.锗单质是一种优良的半导体材料 B.砹化银不溶于水也不溶于稀硝酸
C.硫酸镭是难溶于水的白色固体 D.硒化氢是无色、有毒、比硫化氢稳定的气体
查看答案和解析>>
科目:高中化学 来源: 题型:
关于A(g)+2B(g)===3C(g)的化学反应,下列表示的反应速率最大的是( )
A.v(A)=0.6mol/(L·min) B.v(B)=1.2mol/(L·min)
C.v(C)=1.2mol/(L·min) D.v(B)=0.03mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
在一密闭的2 L容器中装有4 mol SO2和2 mol O2,在一定条件下开始反应。2 min末测得容器中有1.6 mol SO2,请计算:(1)2 min末SO3的浓度;(2)2 min内SO2的平均反应速率(要求:书写完整的解题过程,否则不给分)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com