
| A、NaHSO4在水溶液的电离方程式 NaHSO4?Na++H++SO42- |
| B、氯化铵在氘水中的水解离子方程式 NH4++D2O?NH3.HDO-+D+ |
| C、NaHS在水中的水解离子方程式 HS-+H2O?S2-+H3O+ |
| D、碳酸钙在水中的溶解平衡方程式 CaCO3=Ca2++CO32- |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| 样品甲 | 生成白色沉淀,继续滴加氢氧化钠溶液,沉淀消失 |
| 样品乙 | 生成白色沉淀,白色沉淀迅速变为灰绿色,最终变为红褐色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Zn2+的4s轨道和4p轨道可以形成sp3杂化轨道,那么[ZnCl4]的空间构型为正四面体形 |
| B、NaOH中既有离子键又有共价键和配位键 |
| C、电解饱和食盐水的实验中阳极产生NaOH |
| D、在[Cu(NH3)4]2+离子中,Cu2+提供孤对电子对,NH3提供空轨道 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-=Fe3+ | ||||
| B、用CuCl2溶液做导电性实验,灯泡发光:CuCl2=Cu2++2Cl- | ||||
| C、铅蓄电池充电时的阳极反应:PbSO4+2H2O-2e-=PbO2+4H++SO42- | ||||
D、用铜做电极电解CuSO4溶液:2Cu2++2H2O
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、苯中的C和SO2中的S都采取的是sp2杂化类型 |
| B、N2H4中的N和HClO中的O都采取的是sp3杂化类型 |
| C、乙烯发生加成反应时C原子杂化类型不会发生变化 |
| D、CS2和C2H2中的C都采取的是sp杂化类型 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验操作 | 实验现象 |
| A、将一小块钠投入滴有酚酞的水中 | a、有气体产生,溶液变红 |
| B、将一小段除去氧化膜的镁条放入水中,加热至沸腾、冷却后滴加酚酞试液 | b、剧烈反应,迅速产生气体 |
| C、将一段除去氧化膜的镁条投入稀盐酸中 | c、反应较剧烈,有气体产生 |
| D、将一小片除去氧化膜的铝片投入与C中浓度相同的稀盐酸中 | d、金属浮于水面,溶成小球,四处游动,溶液变红,并有嘶嘶声 |
| 实验操作 | A | B | C | D |
| 实验现象 |
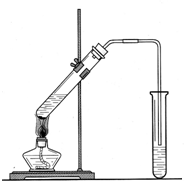
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用手扇动收集的气体,有气味则已收集满 |
| B、将润湿的淀粉KI试纸接近瓶口,试纸变蓝则已收集满 |
| C、将润湿的红色石蕊试纸伸入瓶内,试纸变蓝则已收集满 |
| D、用玻璃棒一端蘸取浓盐酸,接近瓶口,产生大量白烟,证明已收集满 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com