
| 实验操作 | 实验现象 |
| A、将一小块钠投入滴有酚酞的水中 | a、有气体产生,溶液变红 |
| B、将一小段除去氧化膜的镁条放入水中,加热至沸腾、冷却后滴加酚酞试液 | b、剧烈反应,迅速产生气体 |
| C、将一段除去氧化膜的镁条投入稀盐酸中 | c、反应较剧烈,有气体产生 |
| D、将一小片除去氧化膜的铝片投入与C中浓度相同的稀盐酸中 | d、金属浮于水面,溶成小球,四处游动,溶液变红,并有嘶嘶声 |
| 实验操作 | A | B | C | D |
| 实验现象 |
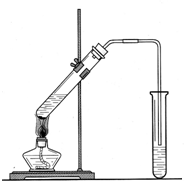
| 实验步骤 | A | B | C | D |
| 实验现象 | d | a | b | c |


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 氧族元素的单质及其化合物对人类的生活、生产有着举足轻重的影响.
氧族元素的单质及其化合物对人类的生活、生产有着举足轻重的影响.| V2O5 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaHSO4在水溶液的电离方程式 NaHSO4?Na++H++SO42- |
| B、氯化铵在氘水中的水解离子方程式 NH4++D2O?NH3.HDO-+D+ |
| C、NaHS在水中的水解离子方程式 HS-+H2O?S2-+H3O+ |
| D、碳酸钙在水中的溶解平衡方程式 CaCO3=Ca2++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com