


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
 某实验小组欲探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签.于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究.
某实验小组欲探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签.于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究.| 实验方案 | 预测现象 | 预测依据 |
| 操作1:向2mL Na2CO3溶液中滴加1mL 0.5mol?L-1CaCl2溶液 | 有白色沉淀 | Na2CO3溶液中的CO32-浓度较大,能与CaCl2发生反应 |
| 操作2:向2mL NaHCO3溶液中滴加1mL 0.5mol?L-1CaCl2溶液 | 无白色沉淀 | NaHCO3溶液中的CO32-浓度很小,不能与CaCl2反应. |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同周期元素中,ⅦA族元素的原子半径最大 |
| B、ⅠA族元素的原子,其半径越大,越容易得到电子 |
| C、室温时,零族元素的单质都是气体 |
| D、所有主族元素的原子,形成单原子离子时的化合价与它的族序数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-=Fe3+ | ||||
| B、用CuCl2溶液做导电性实验,灯泡发光:CuCl2=Cu2++2Cl- | ||||
| C、铅蓄电池充电时的阳极反应:PbSO4+2H2O-2e-=PbO2+4H++SO42- | ||||
D、用铜做电极电解CuSO4溶液:2Cu2++2H2O
|
查看答案和解析>>
科目:高中化学 来源: 题型:
A、Mg2+的结构示意图: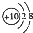 |
B、Na2S的电子式: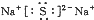 |
| C、氨气的空间结构:三角形 |
| D、乙烯的结构简式:(CH2)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验操作 | 实验现象 |
| A、将一小块钠投入滴有酚酞的水中 | a、有气体产生,溶液变红 |
| B、将一小段除去氧化膜的镁条放入水中,加热至沸腾、冷却后滴加酚酞试液 | b、剧烈反应,迅速产生气体 |
| C、将一段除去氧化膜的镁条投入稀盐酸中 | c、反应较剧烈,有气体产生 |
| D、将一小片除去氧化膜的铝片投入与C中浓度相同的稀盐酸中 | d、金属浮于水面,溶成小球,四处游动,溶液变红,并有嘶嘶声 |
| 实验操作 | A | B | C | D |
| 实验现象 |
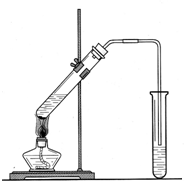
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.4 mol |
| B、0.6 mol |
| C、0.8 mol |
| D、1.2 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
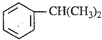 ),是一种重要的有机化工原料.根据题意完成下列填空:
),是一种重要的有机化工原料.根据题意完成下列填空: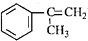 )是生产耐热型ABS树脂的一种单体,工业上由异丙苯催化脱氢得到.写出由异丙苯制取该单体的另一种方法
)是生产耐热型ABS树脂的一种单体,工业上由异丙苯催化脱氢得到.写出由异丙苯制取该单体的另一种方法查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com