
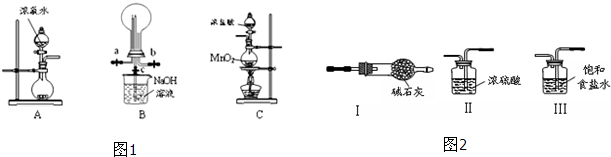


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 实验操作 | 实验现象 |
| A、将一小块钠投入滴有酚酞的水中 | a、有气体产生,溶液变红 |
| B、将一小段除去氧化膜的镁条放入水中,加热至沸腾、冷却后滴加酚酞试液 | b、剧烈反应,迅速产生气体 |
| C、将一段除去氧化膜的镁条投入稀盐酸中 | c、反应较剧烈,有气体产生 |
| D、将一小片除去氧化膜的铝片投入与C中浓度相同的稀盐酸中 | d、金属浮于水面,溶成小球,四处游动,溶液变红,并有嘶嘶声 |
| 实验操作 | A | B | C | D |
| 实验现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
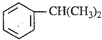 ),是一种重要的有机化工原料.根据题意完成下列填空:
),是一种重要的有机化工原料.根据题意完成下列填空: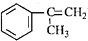 )是生产耐热型ABS树脂的一种单体,工业上由异丙苯催化脱氢得到.写出由异丙苯制取该单体的另一种方法
)是生产耐热型ABS树脂的一种单体,工业上由异丙苯催化脱氢得到.写出由异丙苯制取该单体的另一种方法查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 名称 | 托盘天平 | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  | |
| 序号 | a | b | c | d | e | f |
| 实验 次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸性氧化物 二氧化碳 CO2 |
| B、酸 硫酸 H2S |
| C、碱性氧化物 氢氧化钙 Ca(OH)2 |
| D、碱 纯碱 NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、先装好药品,再检查装置的气密性 |
| B、先用双手捂紧试管,再将导管插入水中检查装置的气密性 |
| C、氢气还原氧化铜的实验,先通一段时间的氢气,后检验氢气纯度,再加热 |
| D、稀释浓硫酸时,先在烧杯里倒入浓硫酸,再小心倒入水并不断搅拌 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com