
| 名称 | 托盘天平 | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  | 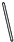 |  |  | |
| 序号 | a | b | c | d | e | f |
| 实验 次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
| 1.3376kJ |
| 0.025mol |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将2.5 g CuSO4?5H2O溶解在97.5 g水中配制质量分数为2.5%的CuSO4溶液 |
| B、配制1 mol/L NaOH溶液时,将溶解后的NaOH溶液立即注入容量瓶 |
| C、将20 mL 5.0 mol/L Na2SO4溶液用水稀释至100 mL配制100 mL 1.0 mol/L Na2SO4 |
| D、配制900 mL 2 mol/L的NaCl溶液时,选用900 mL容量瓶和称取105.3 g NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
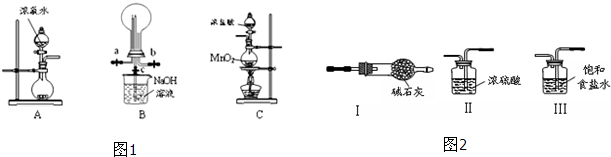
查看答案和解析>>
科目:高中化学 来源: 题型:
 | 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 |
| A | Na2CO3 | H2SO4 | NaHCO3 | SiO2 | CO2 |
| B | NaOH | HCl | NaCl | Na2O | CO |
| C | NaOH | CH3COOH | MgCl2 | CO2 | SO2 |
| D | KOH | HNO3 | CaCO3 | CaO | SO3 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
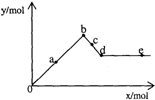 已知Ba(AlO2)2可溶于水.如图表示的是向A12(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系.下列有关叙述正确的是( )
已知Ba(AlO2)2可溶于水.如图表示的是向A12(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系.下列有关叙述正确的是( )| A、a-b时沉淀的物质的量:A1(OH)3比BaSO4多 |
| B、c-d时溶液中离子的物质的量:AlO2-比Ba2+多 |
| C、a-d时沉淀的物质的量:BaSO4可能小于A1(OH)3 |
| D、d-e时溶液中离子的物质的量:Ba2+不可能等于OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知A、B、C是中学化学的常见物质,它们在一定条件下有如下转化关系:
已知A、B、C是中学化学的常见物质,它们在一定条件下有如下转化关系:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com