
| ||
| ||


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 名称 | 托盘天平 | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  | 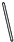 |  |  | |
| 序号 | a | b | c | d | e | f |
| 实验 次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
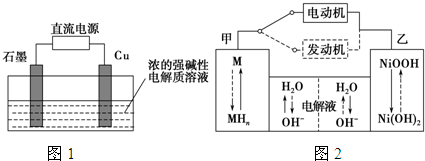
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图表示反应X(g)+Y(s)?Z(s)+R(g)(△H<0)的正、逆反应速率(v)与时间(t)的关系,t1时开始改变条件,则改变的条件符合曲线的是( )
如图表示反应X(g)+Y(s)?Z(s)+R(g)(△H<0)的正、逆反应速率(v)与时间(t)的关系,t1时开始改变条件,则改变的条件符合曲线的是( )| A、减少物质Z | B、升温 |
| C、减压 | D、用催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 科学家最近在-100℃的低温下合成一种烃X,此分子的模型如图(图中的连线表示化学键).
科学家最近在-100℃的低温下合成一种烃X,此分子的模型如图(图中的连线表示化学键).查看答案和解析>>
科目:高中化学 来源: 题型:
| A、提倡双面使用纸张 |
| B、推广一次性竹筷 |
| C、提倡使用太阳能热水器 |
| D、推广公用自行车 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等于2cmol?L-1 |
| B、大于2cmol?L-1 |
| C、小于2cmol?L-1 |
| D、在c~2cmol?L-1之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:
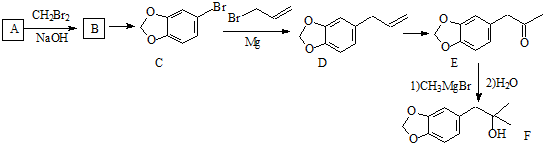
 系统命名为1-溴丙烯.
系统命名为1-溴丙烯.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com