
| 放电 |
| 充电 |
| 25 |
| 2 |
| 25 |
| 2 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
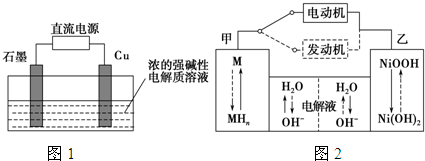
 已知Ba(AlO2)2可溶于水.如图表示的是向A12(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系.下列有关叙述正确的是( )
已知Ba(AlO2)2可溶于水.如图表示的是向A12(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系.下列有关叙述正确的是( )| A、a-b时沉淀的物质的量:A1(OH)3比BaSO4多 |
| B、c-d时溶液中离子的物质的量:AlO2-比Ba2+多 |
| C、a-d时沉淀的物质的量:BaSO4可能小于A1(OH)3 |
| D、d-e时溶液中离子的物质的量:Ba2+不可能等于OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知A、B、C是中学化学的常见物质,它们在一定条件下有如下转化关系:
已知A、B、C是中学化学的常见物质,它们在一定条件下有如下转化关系:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、△H<0、△S>0的反应在任何温度下都能自发进行 |
| B、NH4HCO3(s)═NH3 (g)+H2O(g)+CO2(g)△H=+185.57 kJ?mol-1能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 |
| C、因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据 |
| D、在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
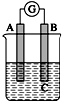 如图所示装置,检流计指针发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的( )
如图所示装置,检流计指针发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的( )| A、A是Zn,B是Cu,C为稀硫酸 |
| B、A是Ag,B是Fe,C为稀AgNO3溶液 |
| C、A是Fe,B是Ag,C为稀AgNO3溶液 |
| D、A是Cu,B是Zn,C为稀硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、中和HCl的物质的量相同 |
| B、两溶液中所含的OH-数目相同 |
| C、NaOH溶液中c(H+)小 |
| D、氨水中c(OH-)大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验内容 | 实验现象 | 实验结论 |
| (1)将两块一样大小的镁条、铁片分别同时加入等体积的0.5mol.L-1的盐酸中. | 影响化学反应速率大小的内因为 | |
| (2)将等体积等浓度(3mol.L-1)的盐酸两份分别同时加入盛有等质量的块状碳酸钙及粉末状碳酸钙的试管中. | 参加反应的固体物质颗粒 | |
| (3)分别将两块同样大小的铁片同时加入等体积不同浓度(3mol.L-1、5mol.L-1、)的盐酸中. | 铁片与 | 反应物的浓度 |
| (4)分别将两块同样大小的铁片放入盛有等体积0.5mol.L-1盐酸的甲乙两试管中,再将甲试管用酒精灯加热,对比观察现象.. | 温度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com