
����Ŀ����ҵ����һ�ַ�������CO2������ȼ�ϼ״���Ϊ̽����Ӧԭ�����ֽ�������ʵ�飬�����Ϊl L���ܱ������У�����lmol CO2��3mol H2��һ�������·�����Ӧ��CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ��H = ��49.0 kJ��mol-1��
CH3OH(g)+H2O(g) ��H = ��49.0 kJ��mol-1��
���CO2��CH3OH(g)��Ũ����ʱ��仯��ͼ��ʾ��
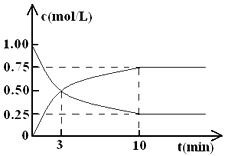
��1���ӷ�Ӧ��ʼ��ƽ�⣬������ƽ����Ӧ����v( H2 )= ________ ��CO2��ת����=________��
��2���÷�Ӧ��ƽ�ⳣ������ʽk=__________ ��
��3�����д�ʩ����ʹn(CH3OH)��n(CO2)�������_________________ (����)��
A����H2O(g)����ϵ�з���B������He(g)��ʹ��ϵѹǿ����
C�������¶� D���ٳ���lmolCO2��3molH2
���𰸡� 0.225mol/(L��min) 75%  AD��
AD��
����������1����������ʽ���ⷨ����
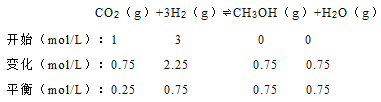
�ӷ�Ӧ��ʼ��ƽ�⣬������ƽ����Ӧ����v��H2��=![]() ==0.225 molL-1min-1��CO2��ת����=0.75/1=0.75��
==0.225 molL-1min-1��CO2��ת����=0.75/1=0.75��
��2��ƽ�ⳣ�������������Ũ����֮�����Է�Ӧ���Ũ����֮������ӦCO2��g��+3H2��g��CH3OH��g��+H2O��g����ƽ�ⳣ��K=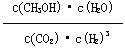 ����3�����д�ʩ����ʹn(CH3OH)��n(CO2)������ǣ�A����H2O��g������ϵ�з��룬ƽ��������Ӧ�����ƶ�����ֵ����A��ȷ��B������He��g����ʹ��ϵѹǿ�����Է�Ӧ������˵��Ũ��û�б仯��ƽ�ⲻ�ƶ�����ֵ���䣬��B����C��������Ӧ���ȣ������¶�ƽ�����淴Ӧ�����ƶ������ֵ��С����C����D���ٳ���1mol CO2��3mol H2������Ӧ��Ũ�ȣ�ƽ��������Ӧ�����ƶ������ֵ����D��ȷ���ʴ�Ϊ��AD��
����3�����д�ʩ����ʹn(CH3OH)��n(CO2)������ǣ�A����H2O��g������ϵ�з��룬ƽ��������Ӧ�����ƶ�����ֵ����A��ȷ��B������He��g����ʹ��ϵѹǿ�����Է�Ӧ������˵��Ũ��û�б仯��ƽ�ⲻ�ƶ�����ֵ���䣬��B����C��������Ӧ���ȣ������¶�ƽ�����淴Ӧ�����ƶ������ֵ��С����C����D���ٳ���1mol CO2��3mol H2������Ӧ��Ũ�ȣ�ƽ��������Ӧ�����ƶ������ֵ����D��ȷ���ʴ�Ϊ��AD��


 һ����������ϵ�д�
һ����������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ӦX��g����3Y��g��![]() 2Z��g������H��0 �ڲ�ͬ�¶ȡ���ͬѹǿ��P1��P2���£��ﵽƽ��ʱ�����������Z����������գ�Z�����¶ȱ仯������Ϊ ( )
2Z��g������H��0 �ڲ�ͬ�¶ȡ���ͬѹǿ��P1��P2���£��ﵽƽ��ʱ�����������Z����������գ�Z�����¶ȱ仯������Ϊ ( )

A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͨ�������£�����ͼ��ʾװ�����Ҷ�ȩ��OHC-CHO���Ʊ��Ҷ��ᣨH00C-COOH�������Ʊ���ӦΪ��OHC-CHO+2Cl2+2H2O��HOOC-COOH+4HCl������˵����ȷ����

A. ÿ����0.1mol�Ҷ�ȩ��Pt1���ų�2.24L���壨��״����
B. Pt1�ĵ缫��ӦΪ��4OH--4e-=2H2O+O2��
C. ÿ�õ�lmol�Ҷ��Ὣ��2molH+������Ǩ�Ƶ�����
D. ���������ṩCl-����ǿ�����Ե�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��±�����������±��ԭ������ý������������ӽ�ϣ��������з�Ӧ(X��ʾ±��ԭ��)��
R��X��2Na��X��R��![]() R��R�䣫2NaX
R��R�䣫2NaX
R��X��NaCN![]() R��CN��NaX
R��CN��NaX
�������и����ʵ�ת����ϵ��գ�

��1��E�Ľṹ��ʽ��______________��
��2��B��D�Ļ�ѧ����ʽ��________________________��
��3��C��F�Ļ�ѧ����ʽ��________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ������У���ӦX2(g)+Y2(g) ![]() 2XY��g������H��0���ﵽ��ƽ�⡣�ڽ��ı�ijһ�����ﵽ��ƽ�⣬�Դ˹��̵ķ�����ȷ���� �� ��
2XY��g������H��0���ﵽ��ƽ�⡣�ڽ��ı�ijһ�����ﵽ��ƽ�⣬�Դ˹��̵ķ�����ȷ���� �� ��
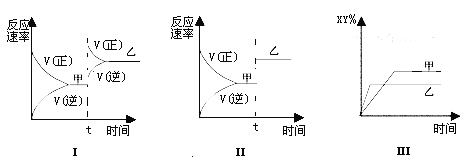
A. ͼ���Ǽ����ʵ������ı仯��� B. ͼ����������������ı仯���
C. ͼ��������ѹǿ�ı仯��� D. ͼ���������¶ȵı仯���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���� Al��CuO��Fe2O3 ��ɵĻ���ﹲ 10.0g������ 500mL ijŨ��������Һ�У��������ȫ�ܽ⣬���� ���� 250mL 2.0mol/L �� NaOH ��Һʱ���õ��ij�����ࡣ�������Ũ��Ϊ�� ��
A. 0.5 mol/L B. 3.0 mol/L C. 1.0 mol/L D. 2.0 mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NA���������ӵ�������ֵ������������ȷ����
A. 60g�����д��ڵĹ��ۼ�����Ϊ10NA
B. 1L 0��1 mol��L-1��NaHCO3��Һ��HCO3-��CO32-��������֮��Ϊ0��1NA
C. ���ڿ�����ȼ�տ����ɶ��������23g�Ƴ��ȼ��ʱת�Ƶ�����Ϊ1 NA
D. 235g����![]() �����ѱ䷴Ӧ��
�����ѱ䷴Ӧ��![]() +
+![]() +
+![]() +10
+10![]() �������������ӣ�
�������������ӣ�![]() ����Ϊ10 NA
����Ϊ10 NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ϴ��ʢ��ֲ���͵��Թ�����ѡ�õ��Լ���( )
A. ϡ���� B. ��ˮ C. �ȼ�Һ D. ϡ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��Ӧ: MnO2 +4HCl��Ũ�� ![]() MnCl2 + Cl2��+ 2H2O����һ�������Ķ��������ܽ��ڹ�����Ũ�����У���Ӧһ��ʱ������ɱ�״��������4.48 L �����跴Ӧǰ����Һ������䣩���Իش��������⣺
MnCl2 + Cl2��+ 2H2O����һ�������Ķ��������ܽ��ڹ�����Ũ�����У���Ӧһ��ʱ������ɱ�״��������4.48 L �����跴Ӧǰ����Һ������䣩���Իش��������⣺
��1���õ����ŷ������÷�Ӧ�е���ת�Ƶķ������Ŀ��______
MnO2 +4HCl��Ũ�� ![]() MnCl2 + Cl2��+ 2H2O
MnCl2 + Cl2��+ 2H2O
��2�����㷴Ӧ���ĵ�MnO2������______ ��
��3�����㱻������HCl���ʵ���______ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com