
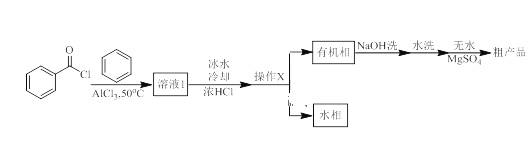
【题目】二苯甲酮广泛应用于药物合成,同时也是有机颜料、杀虫剂等的重要中间体。实验室以苯与苯甲酰氯为原料,在AlCl3作用下制备二苯甲酮的实验流程如下图所示:
相关物理常数和物理性质如下表:
名称 | 相对分 子质量 | 密度/g·cm-3 | 熔点/oC | 沸点/oC | 溶解性 |
苯 | 78 | 0.88 | 5.5 | 80.1 | 难溶水,易溶乙醇 |
苯甲酰氯 | 140.5 | 1.22 | 1 | 197 | 遇水分解 |
无水氯化铝 | 133.5 | 2.44 | 190 | 178(升华) | 遇水水解,微溶苯 |
二苯甲酮 | 182 | 1.11 | 48.5 | 305(常压) | 难溶水,易溶苯 |
已知:反应原理为: 。该反应剧烈放热。
。该反应剧烈放热。
回答下列问题:
(1)反应装置如图所示(加热和夹持装置已略去),迅速称取7.5 g无水三氯化铝放入三颈瓶中,再加入30 mL无水苯,搅拌,缓慢滴加6 mL新蒸馏过的苯甲酰氯。反应液由无色变为黄色,三氯化铝逐渐溶解。混合完后,保持50℃左右反应1.5~2 h。
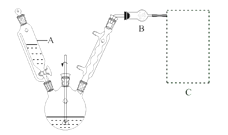
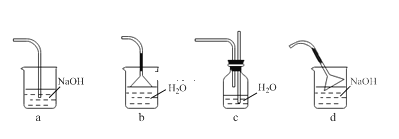
仪器A的名称为_______。装置B的作用为_______。缓慢滴加苯甲酰氯的原因是______。能作为C中装置的是_______(填标号)。
(2)操作X为___________。
(3)NaOH溶液洗涤的目的是_____________。
(4)粗产品先经常压蒸馏除去__________,再减压蒸馏得到产品。
(5)当所测产品熔点为________时可确定产品为纯品。已知实验最终所得纯品8.0 g,则实验产率为_________ %(保留三位有效数字)。
【答案】恒压滴液漏斗 防止外界空气中水蒸气进入影响实验 控制反应速率,防止反应过于剧烈,放出大量热量而使温度过高 bc 分液 洗去残留的HCl 苯 48.5 84.4
【解析】
苯与苯甲酰氯为原料,在AlCl3作用下制备二苯甲酮, ,实验过程中不能有水,防止三氯化铝水解,装置B的作用为防止外界空气中水蒸气进入影响实验。缓慢滴加苯甲酰氯的原因是控制反应速率,防止反应过于剧烈,放出大量热量而使温度过高。尾气中有HCl,极易溶于水,用C中装置吸收。反应混合液冷却,加浓盐酸后,静置分层,分液后在有机层中加NaOH溶液洗去残留的HCl,用无水MgSO4干燥得粗产品,粗产品先经常压蒸馏除去苯,再减压蒸馏得到产品。
,实验过程中不能有水,防止三氯化铝水解,装置B的作用为防止外界空气中水蒸气进入影响实验。缓慢滴加苯甲酰氯的原因是控制反应速率,防止反应过于剧烈,放出大量热量而使温度过高。尾气中有HCl,极易溶于水,用C中装置吸收。反应混合液冷却,加浓盐酸后,静置分层,分液后在有机层中加NaOH溶液洗去残留的HCl,用无水MgSO4干燥得粗产品,粗产品先经常压蒸馏除去苯,再减压蒸馏得到产品。
(1)由装置图:仪器A的名称为恒压滴液漏斗。实验过程中不能有水,防止三氯化铝水解,装置B的作用为防止外界空气中水蒸气进入影响实验。缓慢滴加苯甲酰氯的原因是控制反应速率,防止反应过于剧烈,放出大量热量而使温度过高。尾气中有HCl,极易溶于水,用C中装置吸收,能作为C中装置的是bc(填标号)。
故答案为:恒压滴液漏斗;防止外界空气中水蒸气进入影响实验;控制反应速率,防止反应过于剧烈,放出大量热量而使温度过高;bc;
(2)制备二苯甲酮的反应混合物,冷却、加浓盐酸后分成两相,有机相和水相,用分液的方法分离,操作X为分液。
故答案为:分液;
(3)分液后得到的有机相中含有HCl,NaOH溶液洗涤的目的是洗去残留的HCl 。
故答案为:洗去残留的HCl ;
(4)苯和二苯甲酮互溶,沸点不同,粗产品先经常压蒸馏除去苯,再减压蒸馏得到产品。
故答案为:苯;
(5)纯净物具有固定的熔点,二苯甲酮的熔点为48.5℃,当所测产品熔点为48.5℃时可确定产品为纯品。
30mL苯(密度0.88g·mL-1)的物质的量为![]() mol=0.34mol,6 mL新蒸馏过的苯甲酰氯物质的量为
mol=0.34mol,6 mL新蒸馏过的苯甲酰氯物质的量为![]() mol=0.05210mol,由制备方程式可知,苯过量,所以产品的理论产量为0.05210mol×182g·mol-1=9.482g,则本实验中苯乙酮的产率为
mol=0.05210mol,由制备方程式可知,苯过量,所以产品的理论产量为0.05210mol×182g·mol-1=9.482g,则本实验中苯乙酮的产率为![]() ×100%=84.4%,
×100%=84.4%,
故答案为:48.5;84.4;


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增加。A是元素Y的单质。常温下,甲的浓溶液和A发生钝化。丙、丁、戊是由这些元素组成的二元化合物,且丙是无色气体。上述物质的转化关系如图所示。下列说法正确的是

A. 丁和戊中所含元素种类相同
B. 简单离子半径大小:X<Y
C. 气态氢化物的还原性:X>Z
D. Y的简单离子与Z的简单离子在水溶液中可大量共存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关同分异构体数目的叙述错误的是( )
A.丙烷的一氯代物有 2 种,丙烷的二氯代物有 4 种
B.分子式为 C7H8O 且属于芳香族化合物的同分异构体有 5 种
C.联苯![]() 的一氯代物有 3 种,二氯代物有 12 种
的一氯代物有 3 种,二氯代物有 12 种
D.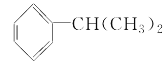 与 Cl2 在光照条件下的取代产物有 3 种
与 Cl2 在光照条件下的取代产物有 3 种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关晶体的结构如图所示,下列说法中不正确的是( )

A. 在NaCl晶体中,距Na+最近的Cl-有6个
B. 在CaF2晶体中,每个晶胞平均占有4个Ca2+
C. 在金刚石晶体中,碳原子与碳碳键个数的比为1∶2
D. 该气态团簇分子的分子式为EF或FE
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备 1,2-二溴乙烷的反应原理如下:
CH3CH2OH![]() CH2=CH2+H2O
CH2=CH2+H2O
CH2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在 l40℃脱水生成乙醚。用少量的溴和足量的乙醇制备 1,2-二溴乙烷的装置如下图所示:
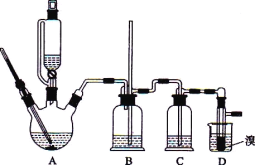
有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/gcm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | 一l30 | 9 | -1l6 |
回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度提高到 170℃ 左右,其最主要目的是_____;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入_____,其目的是吸收反应中可能生成的酸性气体:(填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)若产物中有少量未反应的 Br2,最好用_____洗涤除去;(填正确选项前的字母)
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(4)判断该制各反应已经结束的最简单方法是_____;
(5)若产物中有少量副产物乙醚,可用_____的方法除去;
(6)反应过程中应用冷水冷却装置D,其主要目的是____;但又不能过度冷却(如用冰水),其原因是_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是第3周期11~17号元素某些性质变化趋势的柱形图,下列有关说法中正确的是( )

A. y轴表示的可能是第一电离能
B. y轴表示的可能是电负性
C. y轴表示的可能是原子半径
D. y轴表示的可能是原子形成简单离子转移的电子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻、能量密度大等优良性能,得到广泛应用。回答下列问题:
(1)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为__、__(填标号)。
A.
B.
C.
D.
(2)Li+与H-具有相同的电子构型,r(Li+)小于r(H-),原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组探究SO2与Cu(OH)2悬浊液的反应。
(1)实验一:用如图装置(夹持装置已略,气密性已检验)制备SO2,将SO2通入Cu(OH)2悬浊液的反应中。B中出现少量红色沉淀;稍后,B中所得溶液呈绿色,与CuSO4溶液、CuCl2溶液的颜色有明显不同。
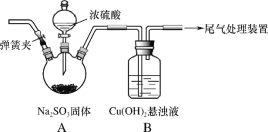
①排除装置中的空气,避免空气对反应干扰的操作是_____,关闭弹簧夹。
②打开分液漏斗旋塞,A中发生反应的方程式是_____。
(2)实验二:为确定红色固体成分,进行以下实验:
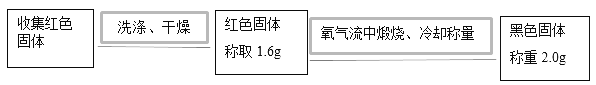
①在氧气流中煅烧红色固体的目的是_____。
②根据上述实验可得结论:该红色固体为_____。
(3)实验三:为探究B中溶液呈绿色而不是蓝色的原因,实验如下:
i.向4mL1mol/L的CuSO4溶液中通入过量SO2,未见溶液颜色发生变化。
ii.取少量B中滤液,加入少量稀盐酸,产生无色刺激性气味的气体,得到澄清的蓝色溶液。再加入BaCl2溶液,出现白色沉淀。
查阅资料:SO2在酸性条件下还原性较差。
①实验i的目的_____。
②根据上述实验可得结论:溶液显绿色的原因是溶液中含有较多Cu(HSO3)2。小组同学通过进一步实验确认了这种可能性,在少量1mol/L的CuSO4溶液中加入_____溶液,得到绿色溶液。
(4)综上实验可以得出:出现红色沉淀的原因是:_____;(用离子方程式表示)溶液呈现绿色的原因是:_____。(用化学方程式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲元素原子的L电子层上只有一个空原子轨道;乙元素原子的核电荷数为33。根据甲、乙两元素的信息,回答有关问题:
(1)甲的元素符号是____________;其轨道表示式为____________。
(2)乙元素原子的最外层电子排布式为____________,其在元素周期表中的位置是____________。
(3)甲属于____________区元素,乙属于____________区元素。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com