
【题目】向含2mol NaOH、1mol Ba(OH)2、2mol NaAlO2的混合液中慢慢通入CO2至过量,下列有关说法正确的是

A. 整个过程中共发生四个离子反应。
B. 根据现象可判断酸性强弱为:H2CO3>HAlO2>HCO3-
C. 通入3molCO2和通入5molCO2都只产生3mol沉淀
D. 整个过程中生成沉淀的物质的量与通入CO2的体积的图象如图所示:
科目:高中化学 来源: 题型:
【题目】下列关于热化学反应的描述中正确的是( )
A. HCl和NaOH反应的中和热ΔH=﹣57.3 kJ·mol-1![]() ,则H2SO4和Ca(OH)2反应的中和热是ΔH=2×(﹣57.3)kJ·mol-1
,则H2SO4和Ca(OH)2反应的中和热是ΔH=2×(﹣57.3)kJ·mol-1
B. 1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
C. 需要加热才能发生的反应一定是吸热反应
D. CO(g)的燃烧热是283.0 kJ·mol-1![]() ,则2CO2(g)====2CO(g)+O2(g)反应的ΔH=+566.0 kJ·mol-1
,则2CO2(g)====2CO(g)+O2(g)反应的ΔH=+566.0 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是
A. 无色溶液中:Ca2+、Cu2+、Br-、Cl- 、
B. c(ClO-)=1mol·L-1的溶液中:Fe2+、Al3+、Cl-、I-
C. 能使酚酞变红的溶液中:K+、Na+、SiO32-、SO42-
D. ![]() =0.1mol·L-1的溶液中:NH4+、Mg2+、SO42-、CH3COO-
=0.1mol·L-1的溶液中:NH4+、Mg2+、SO42-、CH3COO-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒容密闭容器中进行反应mX(g)+nY(g) ![]() qZ(g)ΔH>0,m+n<q达到平衡时,下列说法正确的是 ( )
qZ(g)ΔH>0,m+n<q达到平衡时,下列说法正确的是 ( )
A. 通入稀有气体使压强增大,平衡将正向移动
B. X的逆反应速率是Y的正反应速率的n/m倍
C. 降低温度,混合气体的平均相对分子质量变小
D. 增加X的物质的量,X的转化率降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B为单质,C为化合物,能实现上述转化关系的是( )
![]()
①若C溶于水后得到强碱溶液,则A可能是Na
②若C溶液遇Na2CO3放出CO2气体,则A可能是H2
③若C溶液中滴加KSCN溶液显红色,则B可能为Fe
④若C溶液中滴加NaOH溶液有蓝色沉淀生成,则B可能为Cu
A. ①② B. ①③ C. ②④ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列分子或离子在酸性条件下都能氧化KI,自身发生如下变化:H2O2→H2O IO![]() →I2 MnO
→I2 MnO![]() →Mn2+ HNO2→NO。如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是( )
→Mn2+ HNO2→NO。如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是( )
A. H2O2 B. HNO2 C. MnO![]() D. IO
D. IO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列根据实验操作和现象所得出的结论正确的是
选项 | 实验操作 | 实验现象 | 结 论 |
A | 用洁净的铂丝蘸取某食盐试样在酒精灯火焰上灼烧 | 火焰显黄色 | 该食盐中不含有KIO3 |
B | 将SO2气体通入到Ba(NO3)2溶液中 | 生成白色沉淀 | 此沉淀是BaSO3 |
C | 取久置的Na2O2粉末,向其中滴加过量的盐酸 | 产生无色气体 | Na2O2没有变质 |
D | 在CuSO4溶液中加入KI溶液,再加入苯,振荡、静置 | 有白色沉淀生成,苯层呈紫色 | 白色沉淀可能为CuI |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化铈(CeO2)是一种重要的稀土氧化物,平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。某课题组以此粉末为原料,设计如下工艺流程对资源进行回收,得到纯净的CeO2和硫酸铁铵晶体。
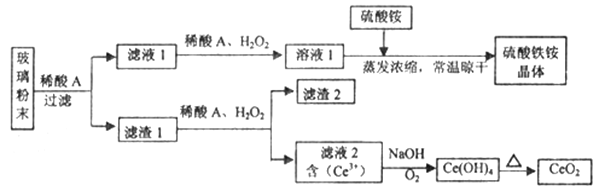
已知:CeO2不溶于稀硫酸,也不溶于NaOH溶液。
回答下列问题:
(1)滤液1中加入H2O2溶液的目的是____________________________________________________。
(2)设计实验证明滤液1中含有Fe2+__________________________________________________________。
(3)在酸性溶液中,已知Fe2+溶液可以和难溶于水的FeO(OH)反应生成Fe3O4,书写该反应的离子方程式____________________________________________________________________。
(4)由滤液2生成Ce(OH)4的离子方程式______________________________________________。
(5)取上述流程中得到的Ce(OH)4产品0.531 g,加硫酸溶解后,用浓度为0.l000 mol·L-1的FeSO4标准溶液滴定至终点时(铈被还原为Ce3+ ),消耗25.00 mL标准溶液。该产品中Ce(OH)4的质量分数为______________ (结果保留两位有效数字),Mr(Ce)=140。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)中和热测定的实验中,用到的玻璃仪器有烧杯、量筒、________、________。
(2)量取反应物时,取50 mL 0.50 mol·L-1的盐酸,还需加入的试剂是________(填序号)。
A.50 mL 0.50 mol·L-1 NaOH溶液
B.50 mL 0.55 mol·L-1 NaOH溶液
C.1.0 g NaOH固体
(3)由甲、乙两人组成的实验小组,在同样的实验条件下,用同样的实验仪器和方法进行两组测定中和热的实验,实验试剂及其用量如下表所示。
反应物 | 起始温度t1/℃ | 终了温度t2/℃ | 中和热/ kJ·mol-1 |
A.1.0 mol/L HCl溶液50 mL、1.1 mol/L NaOH溶液50 mL | 13.0 | ΔH1 | |
B.1.0 mol/L HCl溶液50 mL、1.1 mol/L NH3·H2O溶液50 mL | 13.0 | ΔH2 |
①甲在实验之前预计ΔH1=ΔH2。他的根据是__________________________________;乙在实验之前预计ΔH1≠ΔH2,他的根据是__________________________________。
②实验测得的温度是:A的起始温度为13.0 ℃、终了温度为19.8 ℃;B的起始温度为13.0 ℃、终了温度为19.3 ℃。设充分反应后溶液的比热容c=4.184 J/(g·℃),忽略实验仪器的比热容及溶液体积的变化,则ΔH1=________;ΔH2=________。(已知溶液密度均为1 g/cm3)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com