
【题目】图为用石墨电极电解氯化铜溶液的装置:

(1)与电源正极相连的电极称为____ 极,电极反应式_______;
(2)与电源负极相连的电极称为____ 极,电极反应式_______;
(3)总反应:______。
【答案】阳 2Cl--2e-= Cl2↑ 阴 Cu2++2e- =Cu CuCl2![]() Cu+Cl2↑
Cu+Cl2↑
【解析】
电解氯化铜溶液时,阳极发生失电子的氧化反应,电极反应为:2Cl--2e- =Cl2↑,阴极发生得电子的还原反应,电极反应为:Cu2++2e- =Cu,据此分析解答。
(1)与电源正极相连的电极称为电解池的阳极,电解氯化铜溶液时,阳极发生氧化反应,电极反应式为2Cl--2e- = Cl2↑,故答案为:阳;2Cl--2e- = Cl2↑;
(2)与电源负极相连的电极称为电解池的阴极,电解氯化铜溶液时,阴极发生得电子的还原反应,电极反应式为:Cu2++2e- =Cu,故答案为:阴;Cu2++2e- =Cu;
(3)阴极上铜离子得电子析出铜单质,阳极上氯离子失电子生成氯气,电解池发生总反应:CuCl2 ![]() Cl2↑+Cu,故答案为:CuCl2
Cl2↑+Cu,故答案为:CuCl2 ![]() Cl2↑+Cu。
Cl2↑+Cu。


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:
【题目】(1)1.00 L 1.00 mol·L-1H2SO4溶液与2.00 L 1.00 mol·L-1 NaOH溶液完全反应,放出114.6 kJ热量,该反应的中和热ΔH为___,表示其中和热的热化学方程式为_______________。
(2)在25 ℃、101 kPa时,1.00 g C6H6(l)燃烧生成CO2(g)和H2O(l),放出41.8 kJ的热量,C6H6的燃烧热为____kJ·mol-1,该反应的热化学方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,反应N2(g)+3H2(g)2NH3(g),在1L密闭容器中进行,5min内氨的物质的量增加了0.2mol,则反应速率为( )
A. v(H2)=0.015mol/(L·min)B. v(N2)=0.02mol/(L·min)
C. v(NH3)=0.17mol/(L·min)D. v(NH3)=0.01mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大。W的气态氢化物遇湿润的红色石蕊试纸变蓝色,X是地壳中含量最高的元素,Y在同周期主族元素中原子半径最大,Z与Y形成的化合物的化学式为YZ。下列说法不正确的是()
A.W在元素周期表中的位置是第二周期第VA族
B.同主族中Z的气态氢化物稳定性最强
C.X与Y形成的两种常见的化合物中,阳离子和阴离子的个数比均为2∶1
D.用电子式表示YZ的形成过程为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为Zn-Cu原电池的示意图,请回答:

(1)锌片为原电池的_____极,铜片为原电池的____极(填“正”或“负”)
(2)锌电极反应式是_______,属于______反应(填“氧化”或“还原”);铜电极反应式是______,属于______反应(同上)。
(3)______(填“电子”或“电流”)从锌片通过导线流向铜片,溶液中H+在______(填“锌片”或“铜片”)获得电子。
(4)若锌片减轻0.1mol,则另一极放出气体的物质的量为_____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种物质是含钠元素的单质或化合物,其中A为银白色固体,B为淡黄色固体,它们有如图所示的转化关系:
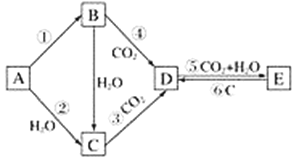
(1)推断各符号所代表的物质的化学式:
A________________,B________________,C________________,D________________,E________________。
(2)分别写出反应②⑤的化学方程式:
②________________________________________________________________________;
⑤________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在25℃,101kPa下,lg C8H18(辛烷)(相对分子质量:114)燃烧生成二氧化碳和液态水时放出48.40kJ热量。表示上述反应的热化学方程式正确的是( )
A. C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(g);△H=-48.40kJ·mol-1
B. C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1);△H=-5518kJ·mol-1
C. C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1);△H=+5518kJ·mol-1
D. C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1);△H=-48.40kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铝合金(硬铝)中含有镁、铜、硅,为了测定该合金中铝的含量,有人设计如下实验:
(1)称取样品ag。
(2)将样品溶于足量稀盐酸中,过滤,滤液中主要含有___离子,滤渣中含有___;在溶解过滤时使用的仪器有___。
(3)往滤液中加入过量NaOH溶液,过滤,写出该步操作中有关的离子方程式____。
(4)在第(3)步的滤液中通入足量CO2过滤,将沉淀用蒸馏水洗涤数次后,烘干并灼烧至质量不再减少为止,冷却后称量,质量为bg。有关反应的化学方程式为____。
(5)计算该样品中铝的质量分数的表达式为___。
(6)若第(3)步中加入NaOH溶液的量不足时,会使测定的结果___(“偏高”“偏低”或“无影响”,下同)。若第(4)步对沉淀的灼烧不充分时,会使测定的结果___。若第(4)步中的沉淀没有用蒸馏水洗涤时,会使测定的结果____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把13g Zn放入足量的盐酸中,Zn完全反应。计算:
(1)13g Zn的物质的量___________
(2)参加反应的HCl的物质的量___________
(3)生成H2的体积(标准状况)___________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com