
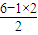 =4,孤电子对数为2,为V形;BBr3中心原子B原子的价层电子对数=3,不含孤对电子,为平面正三角形,
=4,孤电子对数为2,为V形;BBr3中心原子B原子的价层电子对数=3,不含孤对电子,为平面正三角形,

科目:高中化学 来源: 题型:
 (2011?江山市模拟)第28届夏季奥运会在北京成功举办,向世界人民展示了中国人的风采和北京的魅力.奥运五环象征着五大洲的团结以及全世界运动员以公正、坦率的比赛和友好的精神.“北京欢迎您”不仅是北京奥运会的主题歌也是吉祥物的“名字”也正好是五个环相一致(如图所示).
(2011?江山市模拟)第28届夏季奥运会在北京成功举办,向世界人民展示了中国人的风采和北京的魅力.奥运五环象征着五大洲的团结以及全世界运动员以公正、坦率的比赛和友好的精神.“北京欢迎您”不仅是北京奥运会的主题歌也是吉祥物的“名字”也正好是五个环相一致(如图所示).






 或
或
 或
或
查看答案和解析>>
科目:高中化学 来源: 题型:
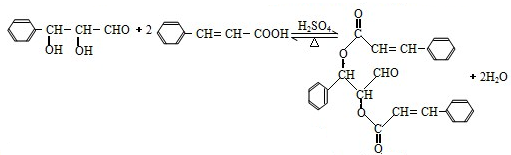
 ,现有A、B、C、D、E、F、G、H八种有机物,存在如下图所示的转化关系:
,现有A、B、C、D、E、F、G、H八种有机物,存在如下图所示的转化关系:
| 序号 | ① | ② | ③ | ④ | ⑤ |
| 无机反应物 | NaOH溶液 | 盐酸 | 新制Cu(OH)2 | 稀硫酸 | H2O |
| 反应条件 | 加热 | - | 加热 | 加热 | 催化剂 HgSO4 |
| 催化剂 |
| 催化剂 |




查看答案和解析>>
科目:高中化学 来源: 题型:
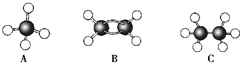
 可简写为
可简写为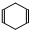 .现有某化合物W的分子结构可表示为:
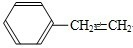
.现有某化合物W的分子结构可表示为: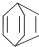 .
.


| 催化剂 |
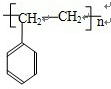

| 催化剂 |





查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)用A、B、C分别表示含有10个电子的微粒(分子),D、E、F、G分别表示含有18个电子的微粒(分子),请回答:
(1) 其中A和D是同系物,则D四氯代物有 种结构
(2) B与E含有相同的元素,B的水溶液呈碱性,E是一种火箭燃料的成分,则E的电子式
(3) C与F含有相同元素,写出F与I-反应的离子反应方程式
(4) G是由两种元素组成的三原子分子,向含8.0g NaOH的溶液中通入一定量G后,将得到的溶液小心蒸干,称得无水物7.9g,则该无水物中一定含有的物质是 (填化学式)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com