
【题目】有X、Y、Z、Q、T五种元素,X原子的M层p轨道有2个未成对电子,Y原子的外围电子构型为3d64s2,Z原子的L电子层的p能级上有一空轨道,Q原子的L电子层的p能级上只有1对成对电子,T原子的M电子层上p轨道半充满。试写出:
(1)X的元素符号____,Y的元素符号___。
(2)Z的电子排布式___,Q的电子排布式___。
(3)Y的单质在Q的单质中燃烧的化学方程式___。
【答案】S Fe 1s22s22p2 1s22s22p4 3Fe+2O2![]() Fe3O4
Fe3O4
【解析】
5种元素X、Y、Z、Q、T,X原子M层上有2个未成对电子且无空轨道,外围电子排布式为3s23p4,则X为S元素;Y原子的外围电子排布为3d64s2,则Y为Fe元素;Z原子的L电子层的p能级上有一个空轨道,外围电子排布式为2s22p2,则Z为C元素;Q原子的L电子层的P能级上只有一对成对电子,外围电子排布式为2s22p4,则Q是O元素;T原子的M电子层上p轨道半充满,外围电子排布式为3s23p3,则T是P元素,据此分析解答。
(1)根据上述分析可知,X是S元素,Y是Fe元素,故答案为:S;Fe;
(2)Z为C元素,核电荷数为6,电子排布式为:1s22s22p2,Q为氧元素,氧原子的核外电子排布式为:1s22s22p4,故答案为:1s22s22p2;1s22s22p4;
(3)Y的单质在Q的单质中燃烧是铁在纯氧中燃烧生成四氧化三铁,反应的化学方程式为:3Fe+2O2![]() Fe3O4,故答案为:3Fe+2O2
Fe3O4,故答案为:3Fe+2O2![]() Fe3O4。
Fe3O4。


 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:
【题目】T ℃时,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示。

根据以上条件,回答下列问题:
(1)A与B反应生成C的化学方程式为________,正反应为_____(填“吸热”或“放热”)反应。
(2)t1 min后,改变下列某一条件,能使平衡向逆反应方向移动的有______(填字母序号)。
A.保持其他条件不变,增大压强
B.保持容器总体积不变,通入少量稀有气体
C.保持其他条件不变,升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S为二元弱酸。20 ℃时,向0.100 mol·L-1的Na2S溶液中缓慢通入HCl气体(忽略溶液体积的变化及H2S的挥发)。下列指定溶液中微粒的物质的量浓度关系一定正确的是( )
A. 通入HCl气体之前: c(S2-)>c(HS-)>c(OH-)>c(H+)
B. c(HS-)=c(S2-)的碱性溶液中: c(Cl-)+c(HS-)>0.100 mol·L-1+c(H2S)
C. pH=7的溶液中: c(Cl-)=c(HS-)+2c(H2S)
D. c(Cl-)=0.100 mol·L-1的溶液中: c(OH-)-c(H+)=c(H2S)-c(S2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量的差别进行发电,在海水中电池总反应可表示为:![]() ,“水”电池在放电时:
,“水”电池在放电时:
(1)该电池的负极的电极反应式为__________________________
(2)![]() 不断向“水”电池的_________极移动
不断向“水”电池的_________极移动
(3)每有![]() 电子转移,生成_________
电子转移,生成_________![]()
(4)将该“水”电池与如图所示的装置相连

![]() 、Y为石墨,a为2L一定物质的量浓度的KCl溶液,电解一段时间发现Y极附近产生了黄绿色气体,写出电解总反应的化学方程式_____________.
、Y为石墨,a为2L一定物质的量浓度的KCl溶液,电解一段时间发现Y极附近产生了黄绿色气体,写出电解总反应的化学方程式_____________.
![]() 、Y分别为铁、铜,a为
、Y分别为铁、铜,a为![]() 和
和![]() 的混合溶液,电池与X、Y的连接方式与
的混合溶液,电池与X、Y的连接方式与![]() 相同,Y极的电极反应式为 ____________.
相同,Y极的电极反应式为 ____________.
(5)室温时,取上述![]() 中
中![]() 电解一段时间后的溶液,除去其中的
电解一段时间后的溶液,除去其中的![]() 且不引入新的杂质
且不引入新的杂质![]() 得到溶液甲,将甲溶液逐滴加入到20ml等物质的量浓度的醋酸中,得到如图
得到溶液甲,将甲溶液逐滴加入到20ml等物质的量浓度的醋酸中,得到如图![]() 不考虑能量损失和气体溶于水,溶液体积变化忽略不计
不考虑能量损失和气体溶于水,溶液体积变化忽略不计![]()

![]() 醋酸的电离平衡常数:C点________B点
醋酸的电离平衡常数:C点________B点![]() 填“
填“![]() ”,“
”,“![]() ”或“
”或“![]() ”
” ![]()
![]() 点溶液中的溶质是:_____________
点溶液中的溶质是:_____________![]() 填化学式
填化学式![]()
![]() 图中,从A点到D点的下列有关说法正确的是______________
图中,从A点到D点的下列有关说法正确的是______________![]() 填字母
填字母![]()
![]() 点时测得溶液中水电离的
点时测得溶液中水电离的![]() 浓度为
浓度为![]() ,则原醋酸溶液的浓度为
,则原醋酸溶液的浓度为![]()
![]() 点时,
点时,![]()
![]() 点时,已知
点时,已知![]() 的
的![]() 大于
大于![]() 的
的![]() ,则溶液中离子浓度的大小关系为:
,则溶液中离子浓度的大小关系为:![]()
![]() 点的溶液
点的溶液![]() 冷却至室温
冷却至室温![]() 等于7
等于7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验装置进行的相应实验,能达到实验目的的是
A.利用图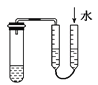 方法验证装置的气密性
方法验证装置的气密性
B.实验室里利用图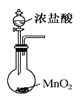 装置制备氯气
装置制备氯气
C.利用图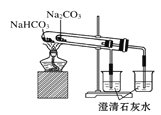 比较碳酸钠和碳酸氢钠的热稳定性
比较碳酸钠和碳酸氢钠的热稳定性
D.利用图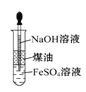 制备Fe(OH)2并能较长时间观察其颜色
制备Fe(OH)2并能较长时间观察其颜色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,二氯化二硫(S2Cl2)为橙黄色液体,遇水易水解,工业上用于橡胶的硫化。某学习小组用氯气和硫单质合成S2Cl2的实验装置如图所示,下列说法不正确的是( )
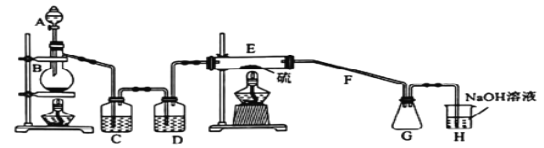
A. 实验时需后点燃E处的酒精灯
B. C、D中所盛试剂为饱和氯化钠溶液、浓硫酸
C. 二氯化二硫(S2Cl2)水解反应产物为S、H2S、HCl
D. G、H之间应加上D装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下合成乙烯:6H2(g)+2CO2(g)![]() CH2===CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法不正确的是( )
CH2===CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法不正确的是( )

A. 该反应的逆反应为吸热反应
B. 平衡常数:KM>KN
C. 生成乙烯的速率:v(N)一定大于v(M)
D. 当温度高于250 ℃,升高温度,催化剂的催化效率降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某课外活动小组设计的用化学电源使LED灯发光的装置。下列说法不正确的是( )

A.装置中存在“化学能→电能→光能”的转化
B.锌片上发生的电极反应为![]()
C.如果将稀硫酸换成柠檬汁,则导线中不会有电子流动
D.如果将锌片换成铁片,则电路中的电流方向不变
查看答案和解析>>
科目:高中化学 来源: 题型:
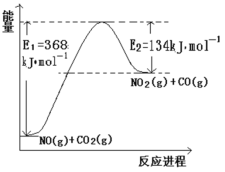
【题目】氮是地球上含量丰富的一种元素,氮元素的单质及其化合物在工农业生产、生活中有着重要作用。
⑴根据下面能量变化示意图,请写出 NO 和 CO2反应的热化学方程式_________。
⑵在固定体积的密闭容器中,进行如下化学反应:2NH3(g)![]() N2(g)+3H2(g) △H>0,其平衡常数 K 与温度 T 的关系如下表:
N2(g)+3H2(g) △H>0,其平衡常数 K 与温度 T 的关系如下表:
T/K | 298 | 398 | 498 |
平衡常数K | 4.1×106 | K1 | K2 |
①试判断 K1_________K2(填写“>”,“<”或“=”);
②该反应的熵变S_________0(填 >、< 或 = )
③下列各项能说明该反应已达到平衡状态的是_________(填字母);
a.容器内N2、H2、NH3的物质的量之比为1∶3∶2 b.2υ(NH3)正 = 3υ(H2)逆
c.容器内混合气体平均相对分子质量保持不变 d.混合气体的密度保持不变
④一定温度下,在 1L 密闭容器中充入 1molN2和 3molH2 并发生反应。若容器容积恒定,10min 达到平衡时,气体的总物质的量为原来的9/10,则N2的转化率![]() (N2)=_________________
(N2)=_________________
⑶对反应 N2O4(g)![]() 2NO2(g) △H > 0 ,在温度分别为T1、T2 时,平衡体系中 NO2的体积分数随压强变化曲线如右图所示,下列说法正确的是__________。
2NO2(g) △H > 0 ,在温度分别为T1、T2 时,平衡体系中 NO2的体积分数随压强变化曲线如右图所示,下列说法正确的是__________。
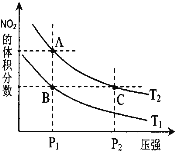
a.A、C 两点的反应速率:A>C
b.A、C 两点的化学平衡常数:A>C
c.A、C 两点 N2O4的转化率:A>C
d.由状态 B 到状态 A,可以用加热的方法
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com